
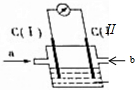
 如右图所示的原电池装置中,电解质溶液为氢氧化钠溶液,a、b分别为H2、O2中的一种,C(Ⅰ)、C(Ⅱ)均为多孔石墨电极.通入气体后,发现电流表指针发生如图所示偏转.则:
如右图所示的原电池装置中,电解质溶液为氢氧化钠溶液,a、b分别为H2、O2中的一种,C(Ⅰ)、C(Ⅱ)均为多孔石墨电极.通入气体后,发现电流表指针发生如图所示偏转.则:分析 电流表指针偏转的方向偏向电流流入电表的方向,可知通入b的电极为正极,通入a的电极为负极,负极发生氧化反应,正极发生还原反应,反应本质是氢气燃烧生成水,负极上是氢气失去电子,碱性条件下生成水,正极上是氧气获得电子,碱性条件下生成氢氧根离子.
解答 解:电流表指针偏转的方向偏向电流流入电表的方向,可知通入b的电极为正极,通入a的电极为负极,反应本质是氢气燃烧生成水,氢气发生氧化反应,氧气发生还原反应.
(1)C(Ⅰ)的电极名称是负极,负极上是氢气失去电子,碱性条件下生成水,即a为氢气,
故答案为:负极;氢气;
(2)C(Ⅱ)为正极,正极上是氧气获得电子,碱性条件下生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-.
点评 本题考查原电池工作原理,关键是根据电流计指针偏转方向判断两极,两极掌握电极判断的方法:如发生的反应、电流流向、电子流向、电解质离子移动方向、电极活性、两极现象等.


科目:高中化学 来源: 题型:解答题
 属于取代反应
属于取代反应 属于取代反应
属于取代反应 属于加聚 反应
属于加聚 反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
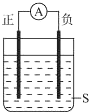
| A. | 正极Cu,负极Al,S为浓HNO3 | B. | 正极Ag,负极Al,S为NaOH | ||
| C. | 正极Ag,负极Cu,S为浓HCl | D. | 正极Zn,负极Cu,S为H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
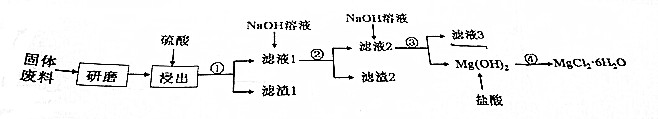
| A. | “浸出”步聚中,可适当提高反应温度、增加浸出时间提高镁的浸出率 | |
| B. | 滤渣1的主要成分是CaSO4,滤液3的主要成分是Na2SO4 | |
| C. | 第1次加Na0H溶液需控制PH的目的是除去Cu2+和Al3+ | |
| D. | ①②③的操作步骤都是过滤,④的操作步骤是蒸发浓缩、冷却结晶、过滤. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
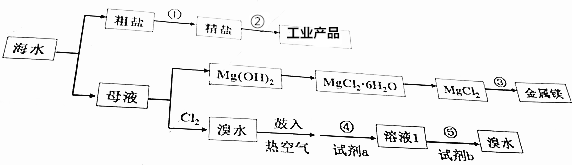
| A. | 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaO溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸 | |
| B. | 步骤②的工业产品包括:H2、Cl2、NaOH、Na | |
| C. | 步骤③的方法为点解饱和MgCl2溶液 | |
| D. | 步骤④、⑤中,若试剂a为SO2水溶液,则试剂b可以是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁氰化钾{K3[Fe(CN)6]}俗称赤血盐,常用于检验Fe3+,遇Fe2+生成深蓝色沉淀,离子反应方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.回答下列问题:
铁氰化钾{K3[Fe(CN)6]}俗称赤血盐,常用于检验Fe3+,遇Fe2+生成深蓝色沉淀,离子反应方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | X与R的核电荷数相差8 | |
| C. | 最高价氧化物对应的水化物的酸性:X>R | |
| D. | Y与Z两者最高价氧化物对应的水化物互不反应 |
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是( )
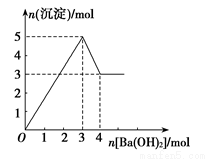
A.MgSO4
B.KAl(SO4)2
C.Al2(SO4)3
D.NaAlO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com