
【题目】用铜、银和硝酸银溶液设计一个原电池,下列对该原电池的判断正确的是
A.铜作负极被氧化 B.银为正极被还原
C.正极反应为:Ag+ + e-=Ag D.NO3-向正极移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高聚物I和J在生产、生活中有广泛应用,其合成路线如图:

已知:通过质谱法测得芳香烃R的最大质荷比为118,其核磁共振氢谱中有5组峰,且峰面积之比为1:2:2:2:3,其苯环上只有一个取代基。
回答下列问题:
(1)反应②的反应类型是___________________。
(2)W在一定条件下能形成含三个六元环的分子,该分子的结构简式为__________________。
(3)T分子中最多有________________个原子共面。
(4)写出反应⑤的化学方程式:_____________________。
(5)H是W的同分异构体,H同时具有下列特征结构的结构简式为__________________。
①能发生银镜反应、水解反应
②遇氯化铁溶液发生显色反应
③含氧官能团位于苯环的对位
④核磁共振氢谱上只有4组峰
(6)仿照上述合成路线,设计一条以R为主要原料制备 的合成路线(无机试剂任选):_______________________。
的合成路线(无机试剂任选):_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中存在广泛用途。

(1)如图是铁元素在元素周期表中的有关信息。
补全铁原子的核外电子排布式_____________3p63d64s2。“55.85”是________________________。自然界中存在的54Fe和56Fe,它们互称为_____________。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是_____________。通常证明某溶液中含Fe2+的化学方法是_____________________。
(3)SO2 有强还原性,写出其与 FeCl3 溶液反应的离子方程式______________________。
若有 0.4mol FeCl3 发生反应,则需要标准状况下的 SO2______________升。
(4)发黄的深井水通常含 Fe3+,若向水中加入 Na2CO3 溶液,则产生红褐色沉淀和无色无味的气体。请从平衡移动角度解释这一现象___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝同主族元素,元素符号是Tl,以下对铊的性质的推析不正确的是( )
A. 铊是易导电的银白色金属 B. 能生成+3价离子
C. 氢氧化铊是两性氢氧化物 D. Tl3+的氧化能力比Al3+弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氢荆芥内酯(F)是有效的驱虫剂。其合成路线为:
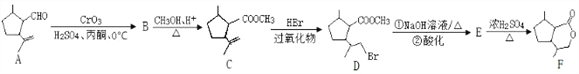
(1)B 的结构简式为__________________。
(2)C→D 的反应类型为___________。
(3)E 分子中的官能团名称为____________________________________。
(4)A 与新制氢氧化铜悬浊液反应的化学方程式_________________________。
(5)写出具有![]() 结构的 C 的一种同分异构体的结构简式___________________。
结构的 C 的一种同分异构体的结构简式___________________。
(6)写出由乙苯制取对溴苯乙烯(![]() )的合成路线。_________
)的合成路线。_________
(合成路线常用的表示方式为: ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小分子抗癌药物的分子结构如图所示,下列说法正确的是

A. 1mol该有机物最多可以和5mol NaOH反应
B. 该有机物容易发生加成、取代、中和、消去等反应
C. 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D. 1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为冰晶石(化学式为Na3AlF6)的晶胞。己知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF63- 。图中●位于大立方体顶点和面心,○位于大立方体的12 条棱的中点和8个小立方体的体心。则下列说法正确的是

A. 冰晶石是原子晶体 B. 该物质中存在配位键
C. 大立方体的体心处△代表的是Al3+ D. 该物质是电解冶炼铝的还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )

A. 化学方程式为:2M![]() N B. t1时,N的浓度是M浓度的2倍
N B. t1时,N的浓度是M浓度的2倍
C. t2时,正逆反应速率相等,达到平衡 D. t3时,若升高温度,正逆反应速率不会变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com