
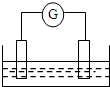
 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:分析 (1)铜锌原电池中,活泼金属作负极,在正极上有气体生成;若电解质为硫酸铜溶液,则在正极上析出铜;
(2)根据反应“2FeCl3+Fe=3FeCl2”可知,反应中铁失电子而被氧化,应为原电池负极,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,依次分析解答;
(3)Mg、Al两种金属做电极,若电解质溶液是稀硫酸,Mg失电子是负极;若电解质溶液换作稀氢氧化钠溶液,Al失电子是负极.
解答 解:(1)将Zn棒和Cu棒用导线连接后,若电解质溶液为稀硫酸,则锌为负极,铜为正极,负极反应为Zn-2e-=Zn2+,正极反应为:2H++2e-=H2↑,在正极上有气体生成;将Zn棒和Cu棒用导线连接后,若电解质为硫酸铜溶液,则在正极上析出铜,锌为负极,负极反应为Zn-2e-=Zn2+,正极反应为Cu2++2e-=Cu,
故答案为:2H++2e-=H2↑;Cu2++2e-=Cu;
(2)由反应“2FeCl3+Fe=3FeCl2”可知,反应中铁失电子而被氧化,应为原电池负极,负极上铁失电子发生氧化反应,正极上铁离子得电子发生还原反应,其电极反应式为:负极为Cu-2e-=Cu2+,正极为2Fe3++2e-=2Fe2+,
故答案为:Fe;Fe-2e-=Fe2+;
(3)Mg、Al两种金属做电极,若电解质溶液是稀硫酸,Mg失电子是负极,电极反应式为:Mg-2e-=Mg2+;若电解质溶液换作稀氢氧化钠溶液,Al失电子是负极,Mg为正极,正反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:Mg-2e-=Mg2+;正极;2Al+2H2O+2OH-=2AlO2-+3H2.
点评 本题考查原电池的设计及原电池的工作原理、电极反应式书写,题目难度不大,利用基础知识可以解答.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
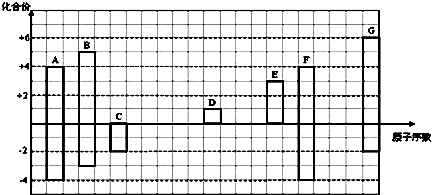
 其所含化学键类型为离子键
其所含化学键类型为离子键 ,C与D形成的具有强氧化性的化合物的电子式为
,C与D形成的具有强氧化性的化合物的电子式为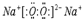

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 微粒 | ClO- | ClO2- | ClO3- | ClO4- |
| 立体结构 | 直线 | V型 | 三角锥形 | 正四面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有1种 | B. | 有2种 | C. | 有3种 | D. | 有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
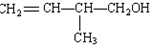
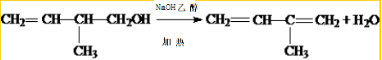 .
.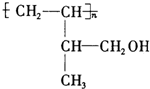 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com