
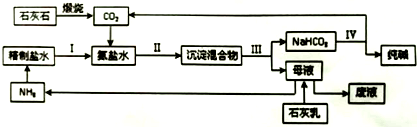
分析 (1)将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成,S元素发生还原反应,C发生氧化反应生成CO,反应方程式为:Na2SO4+CaCO3+4C $\frac{\underline{\;高温\;}}{\;}$Na2CO3+CaS+4CO↑,根据碳酸钠和转移电子之间的关系式计算转移电子物质的量;
(2)石灰石煅烧发生的反应方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,精盐溶液中通入氨气,氨气和水反应生成一水合氨,将CO2通入氨盐水中发生反应NaCl+NH4HCO3=NaHCO3↓+NH4Cl,因为碳酸氢钠溶解度小于碳酸氢铵,所以得到NaHCO3沉淀,过滤得到NaHCO3,向母液中加入Ca(OH)2得到NH3,将NaHCO3分解得到Na2CO3和CO2,反应中CO2和NH3能重复利用; ①镁离子用石灰乳或生石灰除去、钙离子用碳酸根离子除去;
②碳酸氢钠溶解度小于碳酸氢铵,所以氨气、二氧化碳和水、NaCl反应生成溶解度较小的NaHCO3;
在流程图中能参加反应且能生成的物质能循环利用;
③根据各设备的用途判断;
④煅烧石灰石、加热碳酸氢钠都发生分解反应,氨气和水反应为化合反应,碳酸氢铵和氯化钠 发生复分解反应;
(3)加入氨气和氯化钠后还生成可溶性的铵盐;
(4)称量样品的质量,加热分解完成,测定分解后样品质量,根据固体质量差可以计算碳酸氢钠的质量,进而计算样品中碳酸氢钠的质量分数.
解答 解:(1)将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成,S元素发生还原反应,C发生氧化反应生成CO,反应方程式为:Na2SO4+CaCO3+4C $\frac{\underline{\;高温\;}}{\;}$Na2CO3+CaS+4CO↑,该反应中C元素化合价由0价变为+2价、S元素化合价由+6价变为-2价,则转移电子个数是8,即生成1mol碳酸钠转移8mol电子,
故答案为:8mol;
(2)石灰石煅烧发生的反应方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,精盐溶液中通入氨气,氨气和水反应生成一水合氨,将CO2通入氨盐水中发生反应NaCl+NH4HCO3=NaHCO3↓+NH4Cl,因为碳酸氢钠溶解度小于碳酸氢铵,所以得到NaHCO3沉淀,过滤得到NaHCO3,向母液中加入Ca(OH)2得到NH3,将NaHCO3分解得到Na2CO3和CO2,反应中CO2和NH3能重复利用;
①用石灰乳或生石灰与镁离子溶液反应生成氢氧化镁沉淀而除去镁离子,用碳酸钠溶液和钙离子反应生成碳酸钙沉淀而除去钙离子,
故答案为:Ca(OH)2(或CaO);Na2CO3;
②碳酸氢钠溶解度小于碳酸氢铵,所以氨气、二氧化碳和水、NaCl反应生成溶解度较小的NaHCO3,反应方程式为NH3+H2O+NaCl+CO2=NaHCO3↓+NH4Cl(或NH3•H2O+NaCl+CO2=NaHCO3↓+NH4Cl),在流程图中能参加反应且能生成的物质能循环利用,能循环利用的物质有CO2和NH3,故答案为:NH3+H2O+NaCl+CO2=NaHCO3↓+NH4Cl(或NH3•H2O+NaCl+CO2=NaHCO3↓+NH4Cl);CO2和NH3;
③石灰窑煅烧石灰石、碳酸化塔吸收二氧化碳、蒸氨塔蒸发母液得到氨气、吸氨塔吸收氨气,所以没有用到的是沸腾炉,故选B;
④煅烧石灰石、加热碳酸氢钠都发生分解反应,氨气和水反应为化合反应,碳酸氢铵和氯化钠 发生复分解反应,所以没有涉及的反应是置换反应,故选C;
(3)加入氨气和氯化钠后还生成可溶性的铵盐,为NH4Cl,故答案为:NH4Cl;
(4)称量样品的质量m1,加热分解完成,测定分解后样品质量m2,根据固体质量差可以计算碳酸氢钠的质量,进而计算样品中碳酸氢钠的质量分数.
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 固体质量差
168 62
m (m1-m2)
则m=$\frac{168(m1-m2)}{62}$,
故样品中碳酸氢钠的质量分数为$\frac{\frac{168(m1-m2)}{62}}{m1}$=$\frac{84(m1-m2)}{31m1}$,
故答案为:$\frac{84(m1-m2)}{31m1}$( m1是样品质量,m2是样品受热分解后的质量).
点评 本题以氯碱工业为载体考查物质制备,为高频考点,明确流程图中发生的反应、用到的装置、物质的性质是解本题关键,注意:向食盐水中通入氨气和二氧化碳时应该先通入氨气后通入二氧化碳,因为氨气溶解性大、二氧化碳溶解性小,为易错点.本题考查化学与技术,关键是对原理的理解,涉及物质的分离提纯、物质含量测定等,理解掌握中学常见化学工业,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
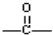
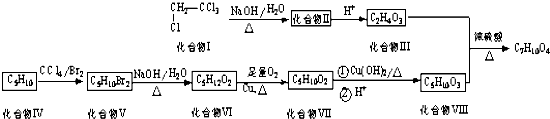
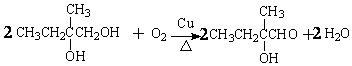 .
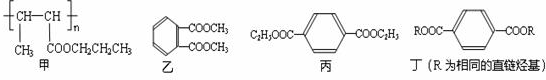
.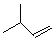 ,该六元环酯(C7H10O4)的结构简式为
,该六元环酯(C7H10O4)的结构简式为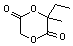 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,60g丙醇中存在的共价键总数为10NA | |
| C. | 1 molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有C-Cl键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
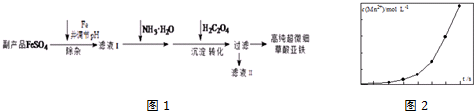
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
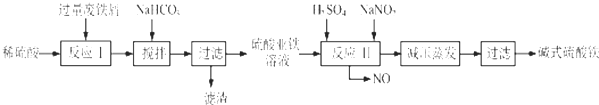
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.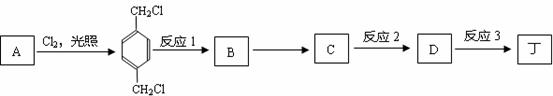
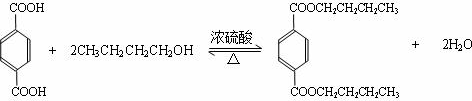 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com