
| A. | 用溴水鉴别甲苯、己烷、己烯 | |
| B. | 将稀硫酸、稀硝酸和苯混合加热制硝基苯 | |
| C. | 苯和硝基苯混合物采用分液的方法分离 | |
| D. | 用CuSO4溶液除去由电石和水反应生成的乙炔气体中的杂质 |
分析 A.甲苯、己烷均与溴水反应,不溶于水,分层现象相同;
B.苯与浓硝酸、浓硫酸制备硝基苯;
C.苯和硝基苯互溶;
D.由电石和水反应生成的乙炔气体中混有硫化氢,硫化氢与硫酸铜反应,而乙炔不能.
解答 解:A.甲苯、己烷均与溴水反应,不溶于水,分层现象相同,不能鉴别,故A错误;
B.苯与浓硝酸、浓硫酸制备硝基苯,浓硫酸作催化剂、吸水剂,故B错误;
C.苯和硝基苯互溶,不能分液分离,应选蒸馏法,故C错误;
D.由电石和水反应生成的乙炔气体中混有硫化氢,硫化氢与硫酸铜反应,而乙炔不能,则利用硫酸铜溶液可除杂,故D正确;
故选D.
点评 本题考查化学实验方案的评价,涉及物质的鉴别和检验、混合物分离提纯,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
| Al3+ | Fe3+ | AlO2- | SiO32- | |
| 开始沉淀时 | 3.4 | 1.9 | 10.6 | 7.3 |
| 沉淀完全时 | 4.7 | 3.2 | 9.3 | 5.3 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
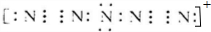 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
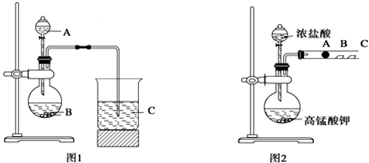
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
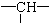 ,其余为氯原子.则氯原子的个数为( )
,其余为氯原子.则氯原子的个数为( )| A. | 2y+3x-x | B. | z+2-x | C. | 2y+z-x | D. | z+2y+2-x |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
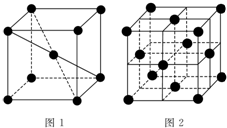 1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.
1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ④⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
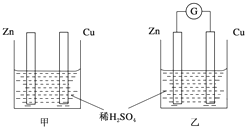 ①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:
①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
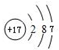 .
.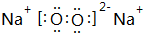 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com