
| A、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高 |
| B、在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
| C、在含有BaSO4沉淀的溶液中加入Na2SO4固体,溶液中c(Ba2+)减小 |
| D、常温下,pH=2的盐酸与pH=12的氨水等体积混合所得溶液c(H+)>c(OH-) |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
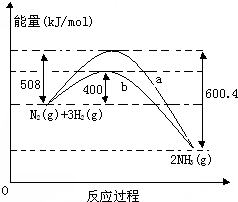 如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线.
如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线.查看答案和解析>>
科目:高中化学 来源: 题型:
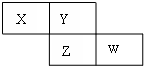 X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A、气态氢化物的稳定性:X>Y |
| B、Z元素的氧化物对应的水化物一定是一种强酸 |
| C、X、Y、Z原子半径的大小顺序:X>Y>Z |
| D、X的气态氢化物与W的气态氢化物可以相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、键长越长,化学键越牢固 |
| B、成键原子间原子轨道重叠越多,共价键越牢固 |
| C、对双原子分子来讲,键能越大,含有该键的分子越稳定 |
| D、原子间通过共用电子对所形成的化学键叫共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅的非金属性比碳的活泼 |
| B、二氧化硅中硅氧键的类型和二氧化碳中碳氧键不同 |
| C、硅氧键的键能比碳氧键的键能大得多 |
| D、二氧化硅晶体类型和二氧化碳晶体不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X和Y不互为手性异构 |
| B、X和Y的所有原子都可能处于同一平面内 |
| C、一定条件下X和Y都可与7molH2加成反应 |
| D、X和Y都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生了锈的铁块放入稀H2SO4中 |
| B、FeCl3、CuCl2的混合溶液中加入过量的铁粉 |
| C、FeO放入稀HNO3中 |
| D、Fe放入HNO3溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com