
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
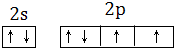 ,
,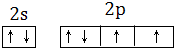 ;
;  ,化合物XYZ的结构式为H-C≡N,
,化合物XYZ的结构式为H-C≡N, ;H-C≡N;
;H-C≡N;| 6+0 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、H216O中,质量数之和是质子数之和的两倍 |
| B、在纯水中加入少量铵盐不会对水的电离产生影响 |
| C、100℃时,纯水的pH=7 |
D、H2O的电子式为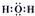 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 资料卡片 | ||
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
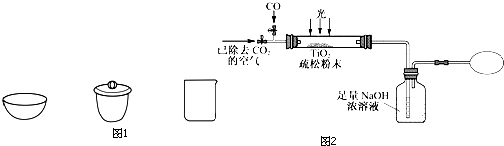
查看答案和解析>>
科目:高中化学 来源: 题型:

| ①B2H6 |
| ②H2O2/OH- |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、K+、OH-、Cl-、NO3- |
| B、Fe2+、H+、Br+、NO3-、Cl- |
| C、Na+、NH4+、SO42-、NO3-、Cl- |
| D、Al3+、H+、Cl-、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:

 、
、 、
、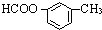 、
、查看答案和解析>>
科目:高中化学 来源: 题型:
 用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)
用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)| △ |
| 温度T | T1 | T2 | T3 |
| 平衡常数K | 1.2 | 2.5 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
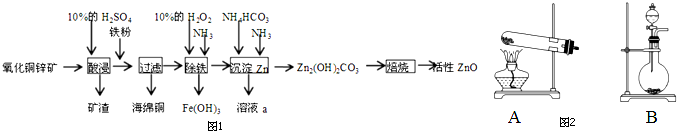
查看答案和解析>>
科目:高中化学 来源: 题型:
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com