
 ,
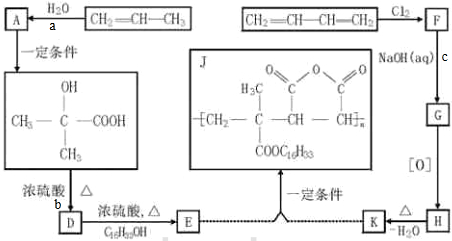
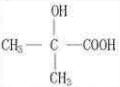
, 反应生成D,D和醇发生酯化反应生成E,E和K反应生成J,根据J的结构简式知,E的结构简式为CH2=C(CH3)COOC16H33,则
反应生成D,D和醇发生酯化反应生成E,E和K反应生成J,根据J的结构简式知,E的结构简式为CH2=C(CH3)COOC16H33,则 发生消去反应生成D,其结构简式为CH2=C(CH3)COOH,则K为
发生消去反应生成D,其结构简式为CH2=C(CH3)COOH,则K为 ,结合转化关系可知,1,3-丁二烯F与氯气发生1,4-加成反应生成F为ClCH2CH=CHCH2Cl,F发生水解反应生成G为HOCH2CH=CHCH2OH,G发生氧化反应生成H为HOOCCH2CH=CHCH2COOH,H发生分子内脱水反应生成K,据此解答.
,结合转化关系可知,1,3-丁二烯F与氯气发生1,4-加成反应生成F为ClCH2CH=CHCH2Cl,F发生水解反应生成G为HOCH2CH=CHCH2OH,G发生氧化反应生成H为HOOCCH2CH=CHCH2COOH,H发生分子内脱水反应生成K,据此解答. ,
, 反应生成D,D和醇发生酯化反应生成E,E和K反应生成J,根据J的结构简式知,E的结构简式为CH2=C(CH3)COOC16H33,则
反应生成D,D和醇发生酯化反应生成E,E和K反应生成J,根据J的结构简式知,E的结构简式为CH2=C(CH3)COOC16H33,则 发生消去反应生成D,其结构简式为CH2=C(CH3)COOH,则K为
发生消去反应生成D,其结构简式为CH2=C(CH3)COOH,则K为 ,结合转化关系可知,1,3-丁二烯F与氯气发生1,4-加成反应生成F为ClCH2CH=CHCH2Cl,F发生水解反应生成G为HOCH2CH=CHCH2OH,G发生氧化反应生成H为HOOCCH2CH=CHCH2COOH,H发生分子内脱水反应生成K,
,结合转化关系可知,1,3-丁二烯F与氯气发生1,4-加成反应生成F为ClCH2CH=CHCH2Cl,F发生水解反应生成G为HOCH2CH=CHCH2OH,G发生氧化反应生成H为HOOCCH2CH=CHCH2COOH,H发生分子内脱水反应生成K,| 浓硫酸 |
| △ |
 ,
,| 浓硫酸 |
| △ |
 .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验记录 | 实验分析或实验结论 | |
| 现象 | 硬质玻璃管内物质由绿色变为红棕色 | 说明生成的物质有 |
| 干燥管内物质颜色由白色变为 | 说明生成的物质有 | |
数据 | 称取绿矾样品质量11.12g | |
| C装置增重1.28g | 说明生成SO2 | |
| A装置中生成白色沉淀4.66g | 说明生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和 |
| ② | ||||
| ③ | ||||
| ④ | 0 |
| KMnO4酸性溶液 的浓度/mol?L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com