
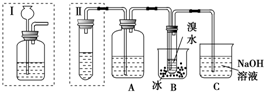
分析 碳化钙和水发生CaC2+2H2O→Ca(OH)2+C2H2↑,因常混有H2S、PH3,可用硫酸铜除去杂质气体,除杂后的乙炔用溴水吸收,根据溴水增重可知生成乙炔的质量,则可知的CaC2质量,进而计算纯度,实验时,因生成氢氧化钙而形成泡沫,注意防止堵塞,装置Ⅰ中使用长颈漏斗来加水,气体容易从长颈漏斗逸出,而且不能随意控制加水的量,以此解答该题.
解答 解:(1)瓶中的液体的作用是除去乙炔中H2S、PH3等杂质气体,可以选用CuSO4溶液,由于酸性高锰酸钾溶液能与乙炔反应生成二氧化碳,所以不能选酸性高锰酸钾溶液;
故答案为:CuSO4溶液; 除去乙炔中混有的H2S和PH3气体;
(2)碳化钙和水反应生成氢氧化钙和乙炔,反应的方程式为CaC2+2H2O→Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(3)I装置中使用长颈漏斗来加水,气体容易从长颈漏斗逸出,而且不能随意控制加水的量;CaC2与水反应剧烈,产生大量泡沫易堵塞导管;在装置的导管口加上一团棉花,可以防止堵塞导管,
故答案为:少量乙炔会从长颈漏斗中逸出,引起实验误差,且不易控制水的添加量;反应产生的泡沫会堵塞导管;给试管导管口处塞上一团棉花;
(4)B处溴水吸收的是乙炔,测得B处溴水增重b g,则乙炔的质量为bg,设参加反应的碳化钙为xg,
CaC2+2H2O=C2H2↑+Ca(OH)2;
64 26
xg bg
$\frac{64}{xg}$=$\frac{26}{bg}$,则x=$\frac{32b}{13}$,
则CaC2的纯度为:$\frac{\frac{32b}{13}}{a}$×100%=$\frac{32b}{13a}$×100%;
故答案为:$\frac{32b}{13a}$×100%.
点评 本题考查物质含量的测定,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理以及操作方法,把握实验的合理性和可行性的评价,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

 .
. .
. +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O.
+NaCl+H2O. +(2n-1)H2O.
+(2n-1)H2O. (写出其中一种结构简式).
(写出其中一种结构简式). )的合成路线示意图.
)的合成路线示意图.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖、油脂、蛋白质和纤维素都由碳、氢、氧元素组成,都是高分子化合物 | |
| B. | 糖、油脂、蛋白质和纤维素都能发生水解 | |
| C. | 葡萄糖和果糖、麦芽糖和蔗糖、淀粉和纤维素,它们间互为同分异构体 | |
| D. | 重金属盐能使蛋白质凝结,故误食重金属盐会中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇中的水:CaO,蒸馏 | B. | 乙酸乙酯中的乙酸:NaOH溶液,分液 | ||
| C. | 乙醇中的苯酚:溴水,过滤 | D. | 乙烷中的乙烯:溴水,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海洋中有丰富的潮汐能、波浪能等新型能源 | |
| B. | 海水蒸发制海盐的过程是化学变化 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| D. | 大海中含有钾、溴、碘等元素,需经过氧化还原反应才可得到钾、溴、碘的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 检验淀粉水解产物的还原性 | 取少量淀粉溶液,与稀硫酸共热后再加入银氨溶液,水浴加热,观察是否出现银镜 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和NaHCO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com