
| m |
| M |
| n |
| V |
| 1.43g |
| 286g/mol |
| 0.005mol |
| 0.1L |
| 20mL×0.05mol/L |
| 0.04mol/L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、用热的纯碱可除去炊具上的油污 |
| B、福尔马林可制备标本是利用了使蛋白质变性的性质 |
| C、含钙、钡等金属元素的物质有绚丽的颜色,可用于制造焰火 |
| D、红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性溶液中:Na+、K+、Fe3+、ClO- |
| B、溶液c(OH-)=10-12mol/L:NH4+、Al3+、NO3-、Cl- |
| C、某透明溶液:MnO4-、Mg2+、SO42-、Na+ |
| D、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
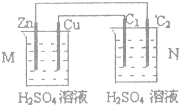
| A、C1上发生还原反应 |
| B、M装置中SO2-4移向Cu电极 |
| C、工作一段时间后装置M中溶液PH变大,装置N中溶液PH变小 |
| D、Cu电极与C2电极上的电极反应不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
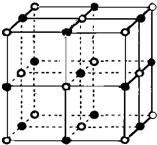 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、1 mol Na202固体中含离子总数为4NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、雾霾有可能产生丁达尔现象 |
| B、城市由于汽车尾气的大量排放,比农村形成雾霾天气的可能性更大 |
| C、氟利昂作制冷剂会加剧雾霾天气的形成 |
| D、雾霾天气严重危害人体健康 |
查看答案和解析>>
科目:高中化学 来源: 题型:
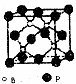 硼是新型无机材料中的明星元素.
硼是新型无机材料中的明星元素.查看答案和解析>>
科目:高中化学 来源: 题型:
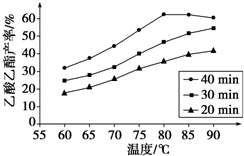 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:| 浓硫酸 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com