
| A. | H2=2H++2e- | B. | H2+2OH--2e-═2H2O | ||
| C. | O2+2H2O+4e-═4OH- | D. | 4H++O2═2H2O-4e- |
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
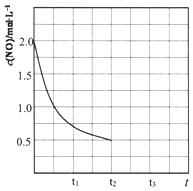 环境问题已成为人类共同关注的话题,燃煤废气、汽车尾气中的氮氧化物(NOx)、CO等有害气体,消除方法有多种.
环境问题已成为人类共同关注的话题,燃煤废气、汽车尾气中的氮氧化物(NOx)、CO等有害气体,消除方法有多种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小容器的体积 | B. | 在体积不变的情况下充入适量H2 | ||
| C. | 适当降低温度 | D. | 在保持压强不变情况下充入适量N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量HCO3-的溶液中:NH4+、Na+、AlO2-、Cl- | |
| B. | PH=13的溶液中:Cl-、CO32-、K+、Na+ | |
| C. | 水电离c(OH-)=10-10mol/L的溶液中:NH4+、Na+、I-、Cl- | |
| D. | 能使甲基橙显红色的溶液中:Fe2+、K+、Cr2O72-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红、红、红 | B. | 红、黑、白 | C. | 红、黑、红 | D. | 白、黑、红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应--减少化石燃料使用,开发清洁能源 | |
| B. | 雾霾--适当限号,减少汽车尾气排放及扬尘 | |
| C. | 白色污染--杜绝生产塑料袋,从根源上治理 | |
| D. | 水体污染--节约用水,减少污水排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com