

| A. | 反应物总键能比生成物总键能大 | B. | H-H键断裂 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
分析 图象分析可知反应物能量高于生成物,反应是放热反应,反应物总键能比生成物总键能小,断键需要吸收热量,常见的放热反应有:所有的燃烧反应,金属与酸或水的反应、酸碱中和反应、铝热反应、多数的化合反应等,其△H<0.常见的吸热反应:Ba(OH)2•8H2O与NH4Cl晶体混合反应、水解反应、大多数的分解反应、以C、CO、H2作为还原剂的反应等,据此判断.
解答 解:A、图象分析可知反应物能量高于生成物,反应是放热反应,反应物总键能比生成物总键能小,故A错误;
B、H-H键断裂需要吸收热量,故B错误;
C、碳酸钙高温分解是吸热反应,故C错误;
D、铝热反应是放热反应,故D正确;
故选D.
点评 本题考查常见的放热反应和吸热反应,应熟记以下反应:常见的放热反应有:所有的燃烧反应,金属与酸或水的反应、酸碱中和反应、铝热反应、多数的化合反应等,其△H<0.常见的吸热反应:Ba(OH)2•8H2O与NH4Cl晶体混合反应、水解反应、大多数的分解反应、以C、CO、H2作为还原剂的反应等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的 | |
| B. | Na在氧气中燃烧主要生成Na2O | |
| C. | 第3周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 1011.8 | 1907 | 2914.1 | 4963.6 | 6273.9 | 21267 | 25431 |
| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | 只有⑤ | C. | ①②③④⑤ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
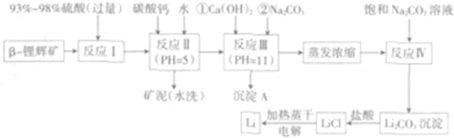
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为3O2═2O3是吸热反应,所以臭氧比氧气的化学性质更活泼 | |
| B. | H2O(g)→H2O(l)的过程放出大量的热,所以该过程是化学变化 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 1 mol/L的稀H2SO4溶液与1 mol/L的稀Ba(OH)2溶液完全反应所放出的热量就是该反应的中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 8 | 1s22s22p4 | 2s22p4 | 第二周期 | ⅥA |
| 24 | 1s22s22p63s23p63d54s1 | 3d54s1 | 第四周期 | ⅥB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
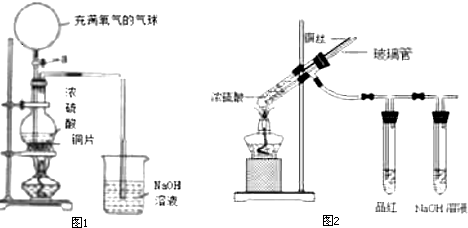
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com