
分析 点燃发生反应:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,再通过足量的过氧化钠,发生反应:2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2,可得总反应方程式分别为:Na2O2+H2=2NaOH、Na2O2+CO=Na2CO3,则过氧化钠固体增重为CO、H2的质量之和.
解答 解:点燃发生反应:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,再通过足量的过氧化钠,发生反应:2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2,可得总反应方程式分别为:Na2O2+H2=2NaOH、Na2O2+CO=Na2CO3,则过氧化钠固体增重为CO、H2的质量之和,即过氧化钠固体会增重14g,
答:过氧化钠固体会增重14g.
点评 本题考查有关混合物反应的计算,关键根据反应方程式寻找质量变化,理解质量变化归纳总结规律,若物质分子组成满足(CO)n.(H2)m,过氧化钠固体增重等于自身质量,若多碳则会多增重,若多氧则会少增重.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器中总压强不再随时间而变化 | |
| B. | v正(B)=0.03mol/(L•s),v逆(D)=1.2mol/(L•min) | |
| C. | 单位时间内断裂一个A-A键,同时生成两个C-C键 | |
| D. | 容器中混合气体的密度不再随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
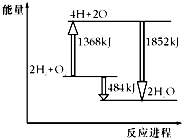 如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法不正确的是( )
如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法不正确的是( )| A. | 拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共吸收484kJ能量 | |
| D. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸与碱恰好完全反应生成正盐的溶液 | |
| B. | pH=7的溶液 | |
| C. | 使石蕊试液呈紫色的溶液 | |
| D. | c(H+)=c(OH-)=10-6mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.15mol | C. | 0.2mol | D. | 0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
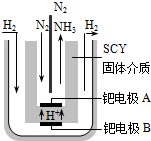 合成氨工业及硝酸工业对工、农生产和国防都有重要意义.请回答:
合成氨工业及硝酸工业对工、农生产和国防都有重要意义.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
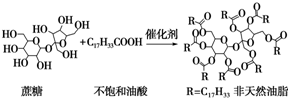
| A. | 蔗糖酯属于油脂类物质 | |
| B. | 该非天然油脂为高分子化合物 | |
| C. | 该非天然油脂与氢氧化钠溶液共热,其水解产物不与溴水反应 | |
| D. | 该蔗糖酯在稀硫酸的作用下水解,最终可生成三种有机化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com