

分析 每消耗1mol Na2S2O3转移8mol e-,根据电子转移守恒,可知S2O32-被氧化生成SO42-,而Cl2被还原为Cl-离子,配平书写离子方程式;
(Ⅰ)甲同学的实验流程中通过加入BaCl2 产生白色沉淀B 来证明Na2S2O3 与氯水反应时有SO42-生成;
(Ⅱ)硫酸根可与钡离子反应生成硫酸钡沉淀;
(Ⅲ)在证明Na2S2O3的还原性时由于不知道BaS2O3 是否是沉淀,所以应先加BaCl2 溶液,如果不产生白色沉淀再加足量氯水产生白色沉淀,即可证明Na2S2O3具有还原性.
解答 解:氯气有强氧化性,能将S2O32-氧化为SO42-,每消耗1mol Na2S2O3转移8mol e-,根据电子转移守恒,可知S2O32-被氧化生成SO42-,而而Cl2被还原为Cl-离子,配平可得离子方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,
故答案为:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+;
(Ⅰ)甲同学的实验流程中通过加入BaCl2 产生白色沉淀B 来证明Na2S2O3 与氯水反应时有SO42-生成,即证明S2O32-具有还原性,故答案为:还原;
(Ⅱ)硫酸根可与钡离子反应生成硫酸钡沉淀,离子方程式是:SO42-+Ba2+=BaSO4↓,故答案为:SO42-+Ba2+=BaSO4↓;
(Ⅲ)在证明Na2S2O3的还原性时由于不知道BaS2O3 是否是沉淀,所以应先加BaCl2 溶液,如果不产生白色沉淀再加足量氯水产生白色沉淀,即可证明Na2S2O3具有还原性,故乙可排除BaS2O3的干扰,
故答案为:乙;可以排除BaS2O3的干扰.
点评 本题考查氧化还原反应、Na2S2O3的化学性质探究,掌握硫、氯及其化合物的性质、氧化还原反应的理解应用是解答关键,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| M | 最高价氧化物对应的水化物能按1:1电离出电子数相等的阴、阳离子 |
| Q | 所在主族序数与所在周期序数之差为4,非金属性在同周期元素中最强 |
| X | 其单质为淡黄色晶体 |
| Y | 某种核素原子的质量数为56,中子数为30 |
| Z | X元素的单质在Z元素的单质中燃烧,发出明亮的蓝紫色火焰 |
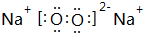
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3- SO42- I- |
| A. | 由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+ | |
| B. | Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O | |
| C. | 原溶液一定只含有的离子I-、NO3-、SO42-、Mg2+、Al3+ | |
| D. | 另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为0.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com