
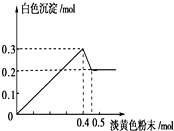
 有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如图所示.
有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如图所示.分析 淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象中加入0.4mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe3+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知氢氧化镁为0.2mol,氢氧化铝为0.3mol-0.2mol=0.1mol,根据元素守恒计算Al3+、Mg2+物质的量,加入0.4mol过氧化钠之后,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,说明此时铵根完全反应,所以产生气体0.3mol即为过氧化钠与水反应生成的氧气和铵根生成的氨气,据此分析解答.
解答 解:淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象中加入0.4mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe3+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知氢氧化镁为0.2mol,氢氧化铝为0.3mol-0.2mol=0.1mol,根据元素守恒计算Al3+、Mg2+物质的量,加入0.4mol过氧化钠之后,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,说明此时铵根完全反应,所以产生气体0.3mol即为过氧化钠与水反应生成的氧气和铵根生成的氨气,
(1)由上述分析可知,淡黄色固体为:Na2O2,名称为过氧化钠,故答案为:过氧化钠;
(2)由上述分析可知,溶液中肯定有离子NH4+、Al3+、Mg2+,肯定没有Fe3+和Cu2+离子,故答案为:NH4+、Al3+、Mg2+;Fe3+和Cu2+;
(3)由纵坐标可知:n(Mg2+)=n[Mg(OH)2]=0.2mol,n(Al3+)=0.3mol-n[Mg(OH)2]=0.1mol.
当n(Na2O2)=0.4mol时,由2Na2O2+2H2O=4NaOH+O2↑,可知n(O2)=0.4mol×$\frac{1}{2}$=0.2mol,所以n(NH4+)=n(NH3)=0.3mol-n(O2)=0.1mol,
故n(Mg2+):n(Al3+):n(NH4+)=0.2mol:0.1mol:0.1mol=2:1:1,
故答案为:n(Mg2+):n(Al3+):n(NH4+)=2:1:1;
(4)①由上述分析可知,淡黄色固体为:Na2O2,与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
②刺激性气味的气体即氨气产生为铵根与氢氧根离子在加热条件下反应生成,离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
③沉淀部分减少即为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查无机离子推断、化学图象计算等,综合性很强,根据图象结合离子反应判断含有的离子是关键,难度很大,注意开始阶段加热,会导致氨气逸出.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 化石燃料在燃烧过程中会产生污染环境的CO、SO2等有害气体 | |
| B. | 直接燃烧煤不如将煤进行深加工后再燃烧的效果好 | |
| C. | 太阳能、氢能、风能、核能、天然气等都属于新能源 | |
| D. | 水煤气是一种二次能源,比煤直接燃烧污染小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
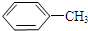 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$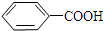
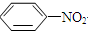 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
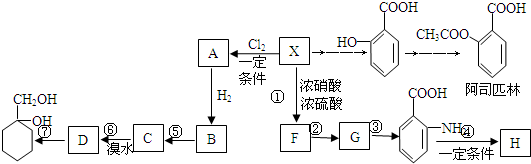
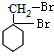 ,G
,G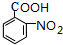 .
.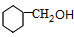 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$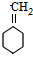 +H2O.
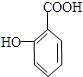
+H2O.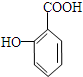 与碳酸氢钠溶液反应:
与碳酸氢钠溶液反应: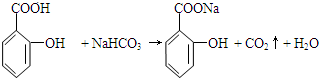 .
. 有多种同分异构体,其中属于芳香族化合物的同分异构体不可能为下列中的ad.
有多种同分异构体,其中属于芳香族化合物的同分异构体不可能为下列中的ad.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | 只有③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Be2+中的质子和电子 | |
| B. | NaHCO3晶体中的阳离子和阴离子 | |
| C. | ${\;}_{1}^{2}$H原子中的中子和质子 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com