
 如图所示,常温常压下气体X(见选项)与O2等物质的量混合后充满圆底烧瓶,挤压胶头滴管并打开止水夹,可观察到烧杯中的水沿导管进入烧瓶.长时间充分反应后,烧瓶中所得溶液的物质的量浓度最小的是(假设溶质不向烧瓶外扩散)( )
如图所示,常温常压下气体X(见选项)与O2等物质的量混合后充满圆底烧瓶,挤压胶头滴管并打开止水夹,可观察到烧杯中的水沿导管进入烧瓶.长时间充分反应后,烧瓶中所得溶液的物质的量浓度最小的是(假设溶质不向烧瓶外扩散)( )| A、NH3 |
| B、HCl |
| C、SO2 |
| D、NO2(假设不含N2O4) |
| 4mol | ||
V×
|
| 5 |
| 8 |
| 4mol | ||
V×
|
| 5 |
| 8 |
| 4mol | ||
V×
|


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 选项 | 操作及现象 | 溶液 |
| A | 通入SO2,溶液不变浑浊,再加氯水,变浑浊 | BaCl2溶液 |
| B | 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| C | 通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| D | 通入NH4HCO3受热分解产生的气体,溶液变浑浊,继续通入该气体,浑浊消失 | Ca(OH)2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、②③④ |
| C、①③⑤ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HX | HY | HZ |
| 电常数 | 9×10-7 | 9×10-6 | 10-2 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应 HZ+Y-═HY+Z-够发生 |
| C、相同温度下,0.1 mol?L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大 |
| D、相同温度下,1 mol?L-1HX溶液的电离常数大于0.1 mol?L-1HX |
查看答案和解析>>
科目:高中化学 来源: 题型:
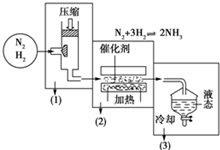 已知海水电解制得的氢气用于合成氨,某合成氨厂生产流程如图:
已知海水电解制得的氢气用于合成氨,某合成氨厂生产流程如图: 查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
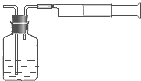 空气中SO2含量是重要的空气质量指标.在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg?Lˉ1
空气中SO2含量是重要的空气质量指标.在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg?Lˉ1查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com