
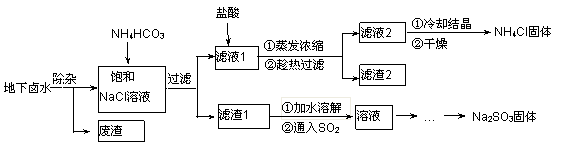
以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。
已知以下四种物质的溶解度曲线图:

(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 、 。
(2)“滤渣1”的化学式为 。
(3)在“滤液1”中加入盐酸的目的是 。“滤渣2”的化学式为 。
物质 | 电离常数(25℃) |
H2CO3 | K1=4.4X10-7 K2=4.7X10-11 |
H2SO3 | K1=1.23X10-2 K2=5.6X10-8 |
(4)已知H2CO3和H2SO3的电离常数如下表,
“通入SO2”反应的化学方程式为 。
科目:高中化学 来源: 题型:
两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积 比为1:2,则第一份与第二份铝屑的质量比为 ( )
A.1:1 B.1:2 C.1:3 D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
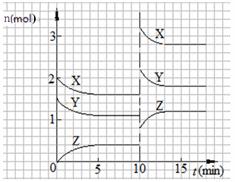
已知反应X(g)+Y(g)  nZ(g) △H<0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如右图。下列说法正确的是( )
nZ(g) △H<0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如右图。下列说法正确的是( )
A.反应方程式中n=2
B.该反应的△S>0
C.10 min时,曲线发生变化的原因是增大压强
D.0~5 min内,平均反应速率v(X)=0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:
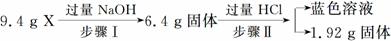
下列有关说法正确的是( )
A.步骤Ⅰ中减少的3 g固体一定是混合物
B.步骤Ⅱ中质量减少的物质一定是Cu
C.根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D.根据上述步骤Ⅱ可以得出m(Fe2O3)∶m(Cu)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
以下化学用语正确的是( )
A.甲醛的结构式: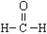 B.乙醇的分子式: CH3CH2OH
B.乙醇的分子式: CH3CH2OH
C.乙烯的结构简式: CH2CH2 D.苯的实验式: C6H6
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应的实质就是旧键的断裂和新键的形成。欲探讨发生化学反应时分子中化学键在何处断裂的问题,近代科技常用同位素示踪原子法。如有下列反应:
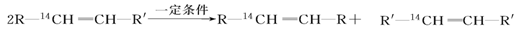

可以推知,物质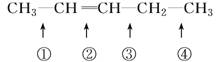 发生此反应时断裂的化学键应是( )
发生此反应时断裂的化学键应是( )
A.①③ B.①④ C.② D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
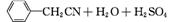

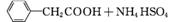
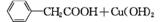
 (
(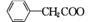 )2Cu+H2O
)2Cu+H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温到130 ℃继续反应。在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是 ,最终得到44 g纯品,则苯乙酸的产率是 。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
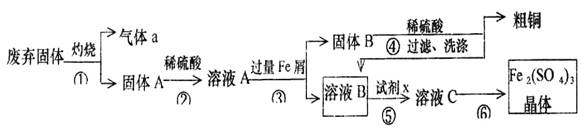
(1)除酒精灯和铁架台或三脚架外,①中所需的容器名称为 ;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为 ;
(3)写出步骤③发生反应的离子方程式 ;
(4)步骤⑥的实验操作为 、过滤、烘干。
(5)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的
SCN—被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol/L硫酸、1.0 mol/LNaOH溶液、0.1 mol/LFe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com