
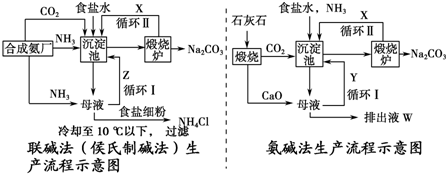
分析 (1)①根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
②联碱法是以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,联合制碱法是向饱和的氯化钠溶液中,先通入氨气后通入过量的二氧化碳,根据溶解度之间的差异得到碳酸氢钠沉淀,碳酸氢钠灼烧分解得到碳酸钠;
③联合制碱法循环物质:氯化钠,二氧化碳,而在氨碱法中循环使用率不高;
(2)①氯酸钾中氯元素的化合价为+5价,反应中元素化合价降低,具有强氧化性;
②电解氯化钠溶液控制条件可以得到氯酸钠和氢气,根据NaCl做还原剂,H2O作氧化剂分析解答;该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有无离子交换膜,需要加热恒温;
(3)制肥皂时,皂化反应结束后,加入食盐有利于肥皂的析出,通过盐析使肥皂析出.
解答 解:(1)①氨气溶于水所得氨水呈碱性,比水更易吸收二氧化碳;向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式分别为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
②在联合制碱法中,联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,放出的二氧化碳气体可回收循环使用,其滤液是含有氯化铵和氯化钠的溶液,第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品,纯碱工厂与合成氨工厂进行联合生产,以便获得原料NH3、CO2,
故答案为:合成氨;NH3、CO2;
③氨碱法的最大缺点在于原料食盐的利用率只有72%~74%,联合制碱法最大的优点是使食盐的利用率提高到96%以上,此外氨碱法与联合制碱法相比,CO2循环使用率也不高,
故答案为:CO2、NaCl;
(2)①处于高价的元素具有氧化性,氯酸钾中氯元素的化合价为+5价,在火柴、炸药、雷管、焰火的制造过程中分解生成氯化钾和氧气,氯元素化合价降低,表现强氧化性,
故答案为:强氧化;
②化合价升高的氯元素被氧化,化合价由-1价升高到+5价,化合价降低的氢元素被还原,化合价由+1价降低到0价,根据氧化还原反应得失电子数相等,反应为:NaCl+3H2O$\frac{\underline{\;通电\;}}{\;}$NaClO3+3H2↑,该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有需要加热恒温控制、没有离子交换膜,
故答案为:NaCl+3H2O$\frac{\underline{\;通电\;}}{\;}$NaClO3+3H2↑;需要加热恒温控制、没有离子交换膜;
(3)工业上制肥皂时,为了使肥皂和甘油充分分离,常向皂化锅中慢慢加入食盐颗粒,将高级脂肪酸钠从混合液中析出,
故答案为:加入食盐使肥皂析出.
点评 本题主要考查了氨碱法(索氏)和联合制碱法(侯氏)的原理、氯酸钾的性质、盐析等知识,掌握原理是解题的关键,题目难度中等.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4的混合溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )| A. | p3>p4,y轴表示A的物质的量 | |
| B. | p3<p4,y轴表示B的体积分数 | |
| C. | p3<p4,y轴表示混合气体的密度 | |
| D. | p3>p4,y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na在空气中燃烧,发出黄色火焰 | B. | Na在空气中燃烧,产物是Na2O | ||
| C. | Na是银白色金属,硬度小,熔点低 | D. | Na、K合金可作原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
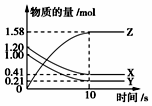 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.079mol•(L•s)-1 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol•L-1 | |
| C. | 该反应不是可逆反应 | |
| D. | 反应的化学方程式为X(g)+Y(g)?Z(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com