
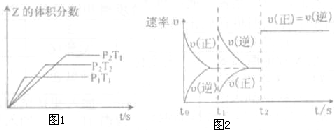
 ��һ�ܱ������з�����Ӧ��2X��g��+Y��g��?aZ��g����H=QkJ?mol-1����ʼ����� ��2��1��X��Y���뷴Ӧ���У�һ�������·�����Ӧ����ͼ1��ͼ2�Ǹ��ݷ�Ӧ���Ƶ�ͼ�������й�˵����ȷ���ǣ�������
��һ�ܱ������з�����Ӧ��2X��g��+Y��g��?aZ��g����H=QkJ?mol-1����ʼ����� ��2��1��X��Y���뷴Ӧ���У�һ�������·�����Ӧ����ͼ1��ͼ2�Ǹ��ݷ�Ӧ���Ƶ�ͼ�������й�˵����ȷ���ǣ�������| A��ͼ1��P1��P2��a��3 | B��ͼ1��T1��T2��Q��0 | C��ͼ2��t1ʱ��ʾ���¡���ѹ�����£���ƽ����ϵ�г���һ������Z���� | D��ͼ2�������=3��t2ʱ��ʾ��������ϵ�м����˴��� |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�



| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������ҵ���ҹ������д���ʮ����Ҫ��λ�ã���ҵ�ϲ��ø�¯ұ�������ó�����̿���������ۼ���ʯ��ʯ����ԭ�ϣ���֪������ԭ����ԭʱ�����еģ���ԭʱ�¶ȼ�CO��CO2ƽ����������CO����������Ĺ�ϵ��ͼ��
������ҵ���ҹ������д���ʮ����Ҫ��λ�ã���ҵ�ϲ��ø�¯ұ�������ó�����̿���������ۼ���ʯ��ʯ����ԭ�ϣ���֪������ԭ����ԭʱ�����еģ���ԭʱ�¶ȼ�CO��CO2ƽ����������CO����������Ĺ�ϵ��ͼ��| ��Ӧ��� | ��ѧ��Ӧ | ��Ӧ�� |
| �� | Fe2O3��s��+3CO��g��=2Fe��s��+3CO 2��g�� | ��H1=-26.7kJ?mol-1 |
| �� | 3Fe2O3��s��+CO��g��=2Fe3O4��s��+CO2��g�� | ��H2=-50.8kJ?mol-1 |
| �� | Fe3O4��s��+CO��g��=3FeO��s��+CO2 ��g�� | ��H3=-36.5kJ?mol-1 |
| �� | FeO��s��+CO��g��=Fe��s��+CO2��g�� | ��H4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
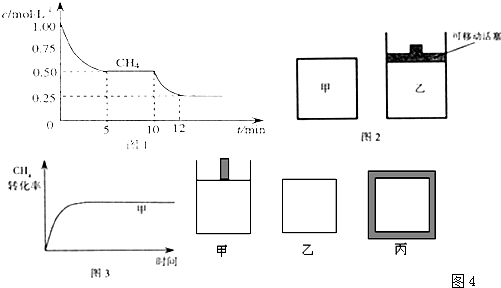
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ������¶Ȳ�����ܱ������з�����4A(g)+B(?)![]() 2C(g)+2D(g)������˵������˵����Ӧ�ﵽƽ�����( )
2C(g)+2D(g)������˵������˵����Ӧ�ﵽƽ�����( )
A.����BΪ���廹�����壬��λʱ�������ɵ�C�����ĵ�B�����ʵ���֮��Ϊ2��1
B.��BΪ���壬������ѹǿ���ٱ仯
C.��BΪ���壬�����������ܶȲ��ٱ仯
D.��BΪ���壬����������ƽ����Է����������ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꽭��ʡ������ѧ����ĩģ�⻯ѧ�Ծ� ���ͣ������
������ҵ���ҹ������д���ʮ����Ҫ��λ�ã���ҵ�ϲ��ø�¯ұ�������ó�����̿���������ۼ���ʯ��ʯ����ԭ�ϡ���֪������ԭ����ԭʱ�����еģ���ԭʱ�¶ȼ�CO��CO2ƽ����������CO����������Ĺ�ϵ����ͼ��

��1������Ԫ�����ڱ���λ�� ���� ��
��2�����¶ȵ���570��ʱ����ԭ��������ɣ����¶ȸ���570��ʱ�����η����Ļ�ԭ��Ӧ�У� ��ѡ����ͼ�е�a��b��c��d��գ�
��3��Ϊ���ٸ�¯ұ��ʱ����CO��β���ŷţ������о�����ȡ���� ��
��a�������������䣬���Ӹ�¯�ĸ߶�
��b�����ڻ�ԭʱ��¯��
��c������ԭ���н�̿�������ı���
��d�������ɵ���ˮ��ʱ�Ƴ�
��4����֪���з�Ӧ��ֵ��
|
��Ӧ��� |
��ѧ��Ӧ |
��Ӧ�� |
|
�� |
Fe2O3(s)��3CO(g)=2Fe(s)��3CO 2(g) |
��H1= -26.7kJ��mol-1 |
|
�� |
3Fe2O3(s)��CO(g)=2Fe3O4(s)��CO2(g) |
��H2= -50.8kJ��mol-1 |
|
�� |
Fe3O4(s)��CO(g)=3FeO(s)��CO2 (g) |
��H3= -36.5kJ��mol-1 |
|
�� |
FeO(s)��CO(g)=Fe(s)��CO2(g) |
��H4 |
��Ӧ�ܡ�H4= kJ��mol-1��
��5��1100��ʱ�� FeO(s)��CO(g)  Fe(s)��CO2(g)��ƽ�ⳣ��K=0.4������һ�ܱ������У�����7.2gFeO��ͬʱͨ��4.48LCO(���ۺ�Ϊ��״��)���������µ�1100�棬��ά���¶Ȳ��䣬��ƽ��ʱ��FeO��ת����Ϊ��
��
Fe(s)��CO2(g)��ƽ�ⳣ��K=0.4������һ�ܱ������У�����7.2gFeO��ͬʱͨ��4.48LCO(���ۺ�Ϊ��״��)���������µ�1100�棬��ά���¶Ȳ��䣬��ƽ��ʱ��FeO��ת����Ϊ��
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com