
| A. | KH的水溶液呈碱性 | B. | KH中氢离子可以被还原为氢气 | ||
| C. | KH是一种强氧化剂 | D. | KH中的氢离子是裸露的质子 |
科目:高中化学 来源: 题型:选择题
| A. | 一氯代物只有一种的烷烃只能是甲烷 | |
| B. | 二氯甲烷无同分异构体,说明甲烷分子是正四面体结构 | |
| C. | 组成上相差一个或多个CH2的有机物一定互为同系物 | |
| D. | 能使酸性高能酸钾溶液褪色的烃一定含有C=C或C≡C |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
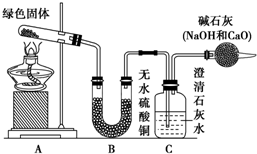 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-817.63 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、HCO3-、SO42- | B. | H+、Fe2+、ClO-、Cl- | ||
| C. | Mg2+、Na+、SO42-、NO3- | D. | Al3+、Ag+、OH-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该混盐具有和漂白粉相似的化学性质 | |
| B. | 该混盐的水溶液呈中性 | |
| C. | 该混盐与硫酸反应生成1摩尔氯气时,转移了1摩尔电子 | |
| D. | 该混盐中氯元素的化合价为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制造普通水泥和玻璃的主要原料都用到石灰石 | |
| B. | 工业上制玻璃不会有温室气体的排放 | |
| C. | 玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料 | |
| D. | “中国”的英文单词叫China,这是由于中国制造的某种物质驰名世界,这种物质是陶瓷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Na+、SO42- | B. | H+、Fe2+、Na+、NO3- | ||
| C. | Ba2+、K+、Al3+、HCO3- | D. | NH4+、Li+、OH-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com