
��15�֣����������Ҫ�ɷ�ΪFeTiO3���ɱ�ʾΪFeO��TiO2������������MgO��SiO2�����ʡ������������Ʊ��������ѣ���һ���Ʊ��ѵ���,������ͼ��
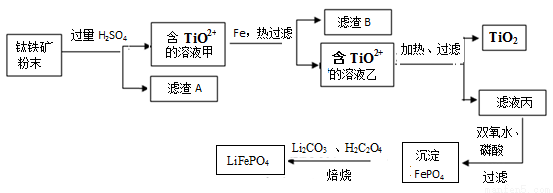
��֪��FeTiO3��4H+��Fe2+��TiO2+��2H2O
���ᣨC2H2O4�����к�ǿ��ԭ�ԣ��ױ������ɶ�����̼
��1��������FeTiO3����Ԫ�صĻ��ϼ��� ��
��2��������������H2SO4�õ�������AΪ_______________���ѧʽ����
��3����TiO2+ ��Һ��ת������TiO2�����ӷ���ʽ�� ��
��4������Һ���Ʊ�LiFePO4�Ĺ����У�����17%˫��ˮ��H2C2O4���������� ��
��5����������ԭ�ζ����ⶨTiO2������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+������KSCN��Һ��ָʾ������NH4Fe��SO4��2����Һ�ζ�Ti3+��ȫ������Ti4+���ζ�����ʱ����ȡTiO2��Ħ������ΪMg/mol������wg������c mol/L NH4Fe��SO4��2����ҺVmL����TiO2��������Ϊ ���ô���ʽ��ʾ����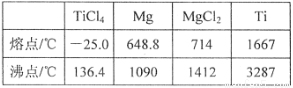
��6��TiO2��ȡ����Ti���漰���IJ������£�
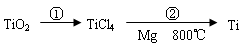
TiCl4 | Mg | MgCl2 | Ti | |
�۵�/�� | -25.0 | 648.8 | 714 | 1667 |
�е�/�� | 136.4 | 1090 | 1412 | 3287 |
��Ӧ�ڵķ���ʽ��___________����TiCl4��Ti��Ҫ��Ar���н��е�������_____________����Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�����ݱ�����Ϣ������ȵ��¶��Ը��� �漴�ɡ�
TiCl4 | Mg | MgCl2 | Ti | |
�۵�/�� | -25.0 | 648.8 | 714 | 1667 |
�е�/�� | 136.4 | 1090 | 1412 | 3287 |
TiCl4 | Mg | MgCl2 | Ti | |
�۵�/�� | -25.0 | 648.8 | 714 | 1667 |
�е�/�� | 136.4 | 1090 | 1412 | 3287 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ï���и����ڶ��θ߿�ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��16�֣����л����ϳɢ����㶹�أ��ĺϳ�·�����£�
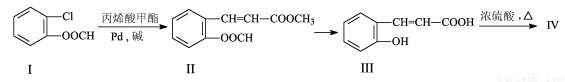
�ش��������⣺
��1��д������ʽ����ϩ�����____________________��
��2��д����Ӧ����:����� ����Ҫ�����ķ�Ӧ��ȫ�������� ��Ӧ��Ҫ�������� ��
��3����֪�����������Է�������Ϊ146��д���ṹ��ʽ���� ��
��4��������V�Ǣ��һ��ͬ���칹�壬V�����������������г������⣬��������״�ṹ���ں˴Ź�������ͼ�У����ĸ����շ壻�ܷ���������Ӧ��1 mol V�������2mol��NaOH��Ӧ��V�Ľṹ��ʽΪ________________��
��5����������֪ʶ��ģ���㶹�غϳ�·�ߵ���ط�Ӧ����д�����ȱ��ͱ�ϩ��CH2=CH-CH3��Ϊԭ�ϣ��ϳ�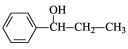 �Ļ�ѧ����ʽ �����Լ���ѡ����
�Ļ�ѧ����ʽ �����Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ�����и���3���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
(����14��)(��)��������(CeO2)��һ����Ҫ��ϡ�������ƽ�������ʾ�����������в��������ķϲ�����ĩ(��SiO2��Fe2O3��CeO2�Լ���������������ϡ�������)��ij�������Դ˷�ĩΪԭ�ϻ����棬���ʵ���������£�
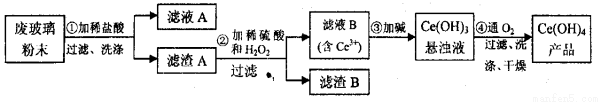
��1��ϴ�ӵ�Ŀ����Ҫ��Ϊ�˳�ȥCl-��___________(�����ӷ���)�����������Aϴ���ķ�����_____________________��
��2���ڢڲ���Ӧ�����ӷ���ʽ��____________________________��
��3��ȡ���������еõ���Ce(OH)4��Ʒ0��536 g���������ܽ����0��1000mol��L-1FeSO4����Һ�ζ��յ�ʱ(�汻��ԭΪCe3��)������25��00mL����Һ���ò�Ʒ��Ce(OH)4����������Ϊ_____________��
(��)����þ��ҽҩ����������ҵӦ�ù㷺������þ��ԭ�Ƚ��Ʊ��ߴ�����þ��һ���µ�̽��������þ��(��Ҫ�ɷ�ΪMgCO3��������FeCO3)Ϊԭ���Ʊ��ߴ�����þ��ʵ���������£�
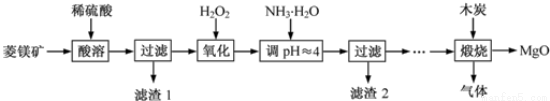
��1������H2O2����ʱ��������Ӧ�Ļ�ѧ����ʽΪ________________��
��2������2�ijɷ���______________(�ѧʽ)��
��3�����չ��̴������·�Ӧ��2MgSO4��C=2MgO��2SO2����CO2��
MgSO4��C=MgO��SO2����CO�� MgSO4��3C=MgO��S����3CO��
������ͼװ�ö����ղ�����������зֲ����ջ��ռ���

��D���ռ������������______________(�ѧʽ)��
��B��ʢ�ŵ���Һ������______________(����ĸ)��
A��NaOH��Һ B��Ca(OH)2��Һ C��ϡ���� D��KMnO4��Һ
��A�еõ��ĵ���ɫ�������ȵ�NaOH��Һ��Ӧ��������Ԫ�����̬Ϊ��4��д���÷�Ӧ�����ӷ���ʽ��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ��ƶ���
����ת����ϵͼ�У�A��B��C��D��E�ڳ�����Ϊ���壬B��E��FΪ���ʣ�����FΪ��ɫ���壻C��D����ʹ�����ʯ��ˮ����ǣ�D��E����ʹƷ����Һ��ɫ��I��һ�ֺ���ɫ�����������Ӧ���й�̬F��G��Ũ��Һ�ڼ���ʱ���ܷ�����Ӧ��
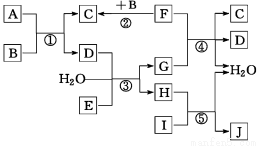
�ش��������⣺
��1��I��һ�ֺ���ɫ��ĩ���׳� �������������ɫ�����Ϳ�ϣ�C�����еĻ�ѧ������Ϊ ��
��2�����������J��Һ��pH=2.0������ˮ���������c(H+) = mol��L��1��
��3����Ӧ�۵����ӷ���ʽΪ ��
��4����Ӧ�ܵĻ�ѧ����ʽΪ ��
��5��A���ܶ�Ϊ2.68 g��L��1����״������ͨ��������������ȷ��A�ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ֪ʶ�ڹ�ũҵ�������ճ�������Ӧ�ù㷺�������й�˵������ȷ����
A���������Ż�ʱ����ˮ����
B�������±���װ���ڳ�����С����ʯ����Ϊ�����
C��ͭ��ˮ��ͷ������ˮ�����Ӵ��������绯ѧ��ʴ��������
D���μ�أ����϶��NaCl��Na2CO3�ȣ���ʩ������ʯ��ɽ��������ļ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ɹŶ�����˹�и���ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�����������ڽ����ơ�������Ͷ����ƣ�Na2Sx���ֱ���Ϊ�����缫�ķ�Ӧ�����Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ����ʱ���ܷ�ӦΪNa2Sx��2Na + xS��3��x��5�����䷴Ӧԭ����ͼ��ʾ������˵���������
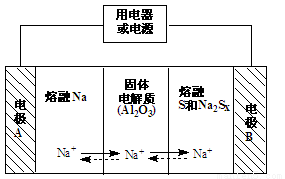
A���ŵ�ʱ���缫AΪ����
B���õ�ع����������¶�Ӧ����10������
C���ŵ�ʱ���ڵ�·��Na+���ƶ�����ΪA��B
D�����ʱ�������ĵ缫��ӦʽΪ Sx2- - 2e-��xS
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�Ĵ�ʡ�����и߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
��1����֪���������Ȼ�ѧ����ʽ��
H2(g)��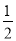 O2(g)===H2O(l) ��H����285.0 kJ/mol
O2(g)===H2O(l) ��H����285.0 kJ/mol
C3H8(g)��5O2(g)===4H2O(l)��3CO2(g) ��H����2220.0 kJ/mol
����֪��H2O(l)===H2O(g) ��H����44.0 kJ�� mol��1��д������ȼ������CO2����̬ˮ���Ȼ�ѧ����ʽ��
_________________________________________��
��ʵ����H2��C3H8�Ļ�����干5 mol����ȫȼ������Һ̬ˮʱ����6262.5 kJ������������H2��C3H8���������______________��
��2����֪��P4(���ף�s)��5O2(g)===P4O10(s) ��H����2983.2 kJ/mol
P(���ף�s)��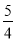 O2(g)===
O2(g)===  P4O10(s) ��H����738.5 kJ/mol
P4O10(s) ��H����738.5 kJ/mol
��д������ת��Ϊ�����Ȼ�ѧ����ʽ____________________________________
��ͬ״���£������ϵ͵���________�������ȶ��ԱȺ��� (��ߡ��͡�)��
��3�֣���˹�����������Ϳ�ѧ�о����к���Ҫ�����壮��Щ��Ӧ�ķ�Ӧ����Ȼ��ֱ�Ӳ�ã�����ͨ����ӵķ����ⶨ���ָ�������3���Ȼ�ѧ��Ӧ����ʽ��
Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=��24.8kJ/mol
3Fe2O3��s��+CO��g��=2Fe3O4��s��+CO2��g����H=��47.2kJ/mol
Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=+640.5kJ/mol
д��CO���廹ԭFeO����õ�Fe�����CO2������Ȼ�ѧ��Ӧ����ʽ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�Ĵ�ʡ�����и߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и��������У��ڼ�����Һ���ܴ������棬����ҺΪ��ɫ������
A��K+ MnO4- Cl- SO42- B��Na+ AlO2- Cl- SO42-
C��SO42- Na+ HCO3- Ba2+ D��Na+ NO3- NH4+ SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�˴��и߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
�л�������A��B����ʽ��ͬ,����ֻ���ܺ�̼���⡢��Ԫ���е����ֻ�����.�����A��B�����Ժ��ֱ������,ֻҪ�����ʵ���֮�Ͳ���,��ȫȼ��ʱ�����ĵ����������ɵ�ˮ�����ʵ���Ҳ����.��ô,A��B��ɱ�������������� �� .��A�Ǽ���,��������������Ļ�����B��,��������С����(д������ʽ) ,��д����������С�ĺ��м���B��2��ͬ���칹��ṹ��ʽ: , ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com