
| A.同pH同体积的氨水和NaOH溶液,能分别与同浓度同体积的盐酸恰好完全中和 |
| B.加水稀释0.10 mol?L-1的氨水,溶液中n(OH-)减小 |
| C.若温度不变,在氨水中加入少量NH4Cl固体,氨水的电离度和电离平衡常数均变小 |
| D.氨水中的离子浓度关系满足:[OH-]=[H+]+[NH4+] |
科目:高中化学 来源:不详 题型:单选题
| A.醋酸溶液能和碳酸钠反应生成CO2和水 |
| B.25℃时,测得0.1mol.L-1醋酸钠溶液的pH约为8 |
| C.25℃时,测得0.1mol.L-1醋酸溶液的pH约为3 |
| D.同温,同浓度、同体积的稀盐酸和稀醋酸分别与足量的锌粒反应,两者生成氢气一样多,但盐酸的反应比醋酸快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
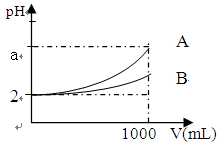
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 醋酸溶液加水稀释,下列说法正确的是()
醋酸溶液加水稀释,下列说法正确的是()| A.溶液中c(H+)和c(OH-)都减小 | B.溶液中c(H+)增大 |
| C.醋酸电离平衡向左移动 | D.溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.35.5∶108 | B.71∶2 | C.108∶35.5 | D.71∶109 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
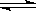 NH+OH-,下列情况能引起电离平衡向正向移动的有 ( )
NH+OH-,下列情况能引起电离平衡向正向移动的有 ( )| A.①③⑤ | B.①④⑥ | C.③④⑤ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
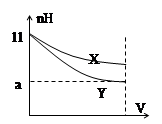
| A.X、Y两种碱的物质的量浓度一定相等 |
| B.稀释后,X溶液碱性比Y溶液碱性强 |
| C.若9<a<11,则X、Y都是弱碱 |
| D.完全中和X、Y两溶液时,消耗同浓度盐酸的体积V(X)>V(Y) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ① | HF | Ka=6.8×10-4 mol?L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol?L-1 |
| ③ | HCN | Ka=6.2×10-10 mol?L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol?L-1 Ka2=4.7×10-11 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com