

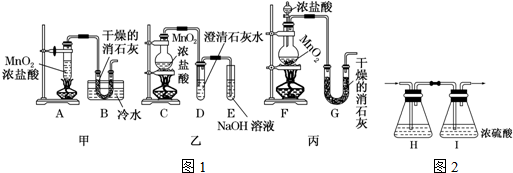
| A. | 该装置图中至少存在两处明显错误 | |
| B. | 烧瓶中的MnO2可换成KClO3或KMnO4 | |
| C. | 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出 | |
| D. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 |
分析 MnO2与浓盐酸在加热的条件下反应生成氯气,也可由KMnO4和浓盐酸在常温下反应生成氯气,氯气有毒,不能直接排放到空气中,应有尾气吸收装置,氯气具有氧化性,可与碘化钾反应生成单质碘.
解答 解:A.MnO2与浓盐酸在加热的条件下反应,图中缺少加热装置,氯气有毒,不能直接排放到空气中,应有尾气吸收装置,故A正确;
B.KMnO4和浓盐酸在常温下反应生成氯气,故B正确;
C.氯气具有氧化性,可与碘化钾反应生成单质碘,淀粉遇碘变蓝色,故C正确;
D.氯气不溶于饱和食盐水,应用NaOH溶液进行尾气吸收,故D错误;
故选D.
点评 本题考查氯气的实验室制备以及氯气的性质,侧重于学生的分析、实验能力的考查,题目难度不大,注意实验制备的原理和装置,把握物质的性质.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁粉跟稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| B. | 铝跟氢氧化钠溶液反应 2Al+2H2O+2OH-=2 AlO2-+3H2↑ | |
| C. | 氯气和水的反应 C12+H2O=2H++C1-+ClO- | |
| D. | 少量铜屑放入稀硝酸中 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 PbO2+Pb+2H2SO4,则该铅蓄电池在充电时阳极的电极反应式:PbSO4-2e-+2H2O═PbO2+SO42-+4H+.
PbO2+Pb+2H2SO4,则该铅蓄电池在充电时阳极的电极反应式:PbSO4-2e-+2H2O═PbO2+SO42-+4H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 莫言 | B. | 屠呦呦 | C. | 侯德榜 | D. | 徐光宪 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
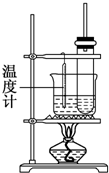 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如图所示.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用“丁达尔现象”区别FeCl3溶液和Fe(OH)3胶体 | |
| B. | BaCl2是一种离子晶体,其在熔融状态下可以导电 | |
| C. | 欲从碘水中得到碘单质,可用酒精做萃取剂 | |
| D. | 欲从KNO3溶液中得到KNO3晶体,可用蒸发结晶法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com