
在分开盛放的M、N两溶液中,各含下列十四种离子中的七种:Al3+、Cl—、Na+、K+、NO3—、OH—、S2—、MnO4—、Fe3+、NH4+、H+、SO42—、AlO2—、CO32—,且两溶液里所含离子不相同,已知M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.NH4+ S2— CO32— B.MnO4— SO42— NO3—
C.NO3— Cl— SO42— D.AlO2— SO42— MnO4—
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
如图所示,试管中集满干燥的氯气,胶头滴管中装有供反应的足量浓氨水。滴入浓氨水,开始时试管内发生的有氧化还原反应:NH3+Cl2→N2+H Cl并产生红光和白烟。
Cl并产生红光和白烟。
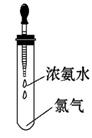
请根据以上反应和现象回答下列问题:
(1)标志反应全部完成的现象是 _______________________________________。
_______________________________________。
(2)反应完毕后,将试管浸入水中并倒立着试管,取下滴管,有水进入试管。在室温时,进入试管内的水约占试管容积的________。
(3)反应中生成的白烟是________。
(4)写出试管中反应的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
 ② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:





 Fe3+ + SO32- + == F e2+ + +
Fe3+ + SO32- + == F e2+ + +
乙同学查阅资料得知:
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| III | 向1 mol•L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是______(填字母)。
a.K3 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶
液,已知其中[CH3COO-]>[Na+],对该混合溶液的下列判断正确的是 ( )
A. [H+]>[OH-] B. [CH3COOH]+[CH3COO-]=0.2 mol/L
C. [CH3COOH]>[CH3COO-] D. [CH3COO-]+[OH-]=0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH=1的溶液中,可以大量共存的离子组是
A. Na+、K+、S2-、Cl- B. Al3+、Mg2+、SO42-、Cl-
C. K+、Na+、AlO2-、NO3- D. K+、Na+、SO42-、S2O32-
查看答案和解析>>
科目:高中化学 来源: 题型:
在10mL0.1mol·L-1NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是
A. c(Na+)>c(Ac-)>c(H+)>c(OH-) B. c(Na+)>c(Ac-)>c(OH-)>c(H+)
C. c(Na+)=c(Ac-)>c(Hac) D. c(Na+)+c(H+)=c(Ac-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
经测定某溶液中只含NH4+、C1-、H+、OH-四种离子,下列说法错误的是
A.若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3·H2O
B.溶液中四种粒子之间不可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
C.若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质一定只有NH4Cl
D.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有I-、NH4+、Na+、SO32-,向该溶液中加入少量溴水,溶液仍成无色,则下列关于溶液组成判断正确的是:
①肯定不含I-;②肯定不含Na+;③肯定含SO32-;④可能含有I-
A. ①③ B. ①②③ C. ②③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
氧元素是地壳中含量最多的元素。下列说法中正确的是( )
A.16O2与18O3互为同位素
B.氧元素与其他短周期非金属元素均能形成酸性氧化物
C.氧与钠形成的稳定化合物中,阴、阳离子个数比均为1∶2
D.O2变成O3以及16O变成18O的变化均属于化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com