
某混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
可能大量含有的阴离子 | Cl-、Br-、I-、CO32—、AlO2— |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
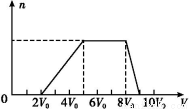
①该溶液中一定不存在的阳离子是 ,
一定不存在的阴离子是 ;含有的阳离子其对应物质的量浓度之比为 ;
②请写出沉淀减少过程中发生反应的离子方程式 。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 11.2 L | 22.4 L | 28.0 L |
n(Cl-) | 2.5 mol | 3.5 mol | 4.0 mol |
n(Br-) | 3.0 mol | 2.5 mol | 2.0 mol |
n(I-) | x mol | 0 | 0 |
①当起始至通入Cl2的体积为22.4 L时,溶液中发生反应总的离子方程式为 ;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为 。
(1)①Ag+、Mg2+、Fe3+ CO32—、AlO2—
c(H+)∶c(NH4+)∶c(Al3+)=2∶3∶1
②Al(OH)3+OH- AlO2—+2H2O
AlO2—+2H2O
(2)①4Cl2+2Br-+6I- 8Cl-+Br2+3I2
8Cl-+Br2+3I2
②1∶2∶1
【解析】(1)向混合液中滴加NaOH溶液,一开始无沉淀生成,说明含有H+;沉淀量最大时继续滴加NaOH溶液,沉淀的量不变,说明含有NH4+,继续滴加,沉淀量减小直至消失,说明含有Al3+,则一定不含有CO32—、AlO2—(均可与Al3+发生水解反应),一定不含有Ag+、Mg2+、Fe3+(与OH-形成的沉淀不能溶于NaOH);由题目所给数据可得出H+、NH4+、Al3+的物质的量之比为:2∶3∶1;H+(0~2V0),NH4+(5V0~8V0),Al3+(8V0~9V0),沉淀减少段发生的反应为:Al(OH)3+OH- AlO2—+2H2O。
AlO2—+2H2O。
(2)当通入Cl2的体积为11.2 L时,溶液中I-还有剩余,即氯气只与I-反应:Cl2+2I- I2+2Cl-,生成1 mol Cl-,Cl-初始物质的量是(2.5-1)mol=1.5 mol,Br-初始物质的量是3 mol;当通入Cl2 22.4 L时,3.0 mol-2.5 mol=0.5 mol 的Br-被氧化:Cl2+2Br-
I2+2Cl-,生成1 mol Cl-,Cl-初始物质的量是(2.5-1)mol=1.5 mol,Br-初始物质的量是3 mol;当通入Cl2 22.4 L时,3.0 mol-2.5 mol=0.5 mol 的Br-被氧化:Cl2+2Br- Br2+2Cl-,消耗Cl2 0.25 mol,所以Cl2+2I-
Br2+2Cl-,消耗Cl2 0.25 mol,所以Cl2+2I- I2+2Cl-,该反应消耗的Cl2为:1 mol-0.25 mol=0.75 mol,因此原溶液中的I-为:0.75 mol×2=1.5 mol,故原溶液中的Cl-、Br-、I-的物质的量浓度之比为1.5∶3∶1.5=1∶2∶1。通入Cl2 22.4 L时,此时参加反应的Cl2、Br-、I-物质的量之比为:1 mol∶0.5 mol∶1.5 mol=2∶1∶3=4∶2∶6,故离子方程式为:4Cl2+2Br-+6I-
I2+2Cl-,该反应消耗的Cl2为:1 mol-0.25 mol=0.75 mol,因此原溶液中的I-为:0.75 mol×2=1.5 mol,故原溶液中的Cl-、Br-、I-的物质的量浓度之比为1.5∶3∶1.5=1∶2∶1。通入Cl2 22.4 L时,此时参加反应的Cl2、Br-、I-物质的量之比为:1 mol∶0.5 mol∶1.5 mol=2∶1∶3=4∶2∶6,故离子方程式为:4Cl2+2Br-+6I- 8Cl-+Br2+3I2。
8Cl-+Br2+3I2。


科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:选择题
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 mol·L-1 NH3·H2O溶液滴定10.00 mL浓度均为0.100 mol·L-1盐酸和CH3COOH溶液的混合溶液,所得曲线如图所示。下列说法正确的是( )
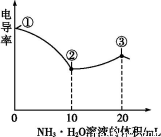
A.①点溶液中c(H+)为0.200 mol·L-1
B.溶液温度高低为①>③>②
C.③点溶液中有c(Cl-)>c(CH3COO-)
D.③点后因离子数目减少使溶液电导率略降低
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题6原子结构化学键练习卷(解析版) 题型:选择题
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5 NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键
C.NH5的电子式为 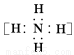 +
+
D.它与水反应的离子方程式为NH4++H-+H2O NH3·H2O+H2↑
NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题4氧化还原反应练习卷(解析版) 题型:填空题
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+ Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是 。
(2)写出CuH在氯气中燃烧的化学反应方程式
(3)CuH溶解在稀盐酸中生成的气体是 ,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题4氧化还原反应练习卷(解析版) 题型:选择题
根据表中信息,判断下列叙述中正确的是( )
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① |
| FeBr2 | / |
| Cl- |
② | KClO3 | 浓盐酸 | / | Cl2 |
|
③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6NA
D.表中③组反应的离子方程式为:2MnO4—+3H2O2+6H+ 2Mn2++4O2↑+6H2O
2Mn2++4O2↑+6H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题3离子反应练习卷(解析版) 题型:选择题
下列各组离子在指定溶液中一定能大量共存的是( )
A.能使甲基橙呈红色的溶液:Ba2+、Al3+、NO3—、Cl-
B.由水电离出的c(H+)=1×10-11 mol·L-1的溶液:Na+、Mg2+、Cl-、NO3—
C.0.2 mol·L-1的NaNO3溶液:H+、Fe2+、SO42—、Cl-
D.与Fe反应生成H2的溶液:NH4+、K+、SO42—、CO32—
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题2化学计量及其应用练习卷(解析版) 题型:填空题
甲乙两位同学分别用不同的方法配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为 。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是
若定容时仰视刻度线,则所配溶液浓度 (填“偏大”、“偏小”或“无影响”)。
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是 。
③定容的正确操作是 。
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是 (填序号)。
A.吸出多余液体,使凹液面与刻度线相切
B小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓盐酸
D.重新配制
(3)乙学生:用100 mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,再搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题1物质的分类分散系练习卷(解析版) 题型:选择题
下列事实与胶体性质无关的是( )
A.一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞
B.在河流入海口处易形成三角洲
C.清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象
D.Na2SO4溶液中滴加BaCl2溶液产生白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com