
分析 ①用洁净的铂丝蘸取少量溶液灼烧,火焰呈黄色,证明含有钠离子;
②溶液中加入足量的稀盐酸,无气体放出,一定没有CO32-,再加入Ba(NO3)2溶液后,产生白色沉淀,一定含有SO42-;
③往上一步所得滤液中加入硝酸银溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,沉淀是氯化银,但是前边加入的过量盐酸含有氯离子,所以原来的溶液中氯离子是否存在无法判断,据此回答该题.
解答 解:①用洁净的铂丝蘸取少量溶液灼烧,火焰呈黄色,证明含有钠离子;
②溶液中加入足量的稀盐酸,无气体放出,一定没有CO32-,再加入Ba(NO3)2溶液后,产生白色沉淀,一定含有SO42-;
③往上一步所得滤液中加入硝酸银溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,沉淀是氯化银,但是前边加入的过量盐酸含有氯离子,所以原来的溶液中氯离子是否存在无法判断,
综上,溶液中一定存在:Na+、SO42-,一定不存在CO32-,其余离子无法判断.
(1)铵盐可以和强碱加热下反应产生氨气,为了确定NH4+是否存在,应补充的操作是:加入足量NaOH溶液,加热,看是否产生能使湿润的红色石蕊试纸变蓝的气体,故答案为:加入足量NaOH溶液,加热,看是否产生能使湿润的红色石蕊试纸变蓝的气体;
(2)溶液中一定存在:Na+、SO42-,一定不存在CO32-,故答案为:Na+、SO42-;CO32-;
(3)操作③的目的是检验氯离子,但是实验②溶液中加入足量的稀盐酸,过量盐酸含有氯离子,会干扰检验,所以原来的溶液中氯离子是否存在无法判断,故答案为:Cl-;验②溶液中加入足量的稀盐酸,过量盐酸含有氯离子,会干扰检验,所以原来的溶液中氯离子是否存在无法判断.
点评 本题考查了常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及正确的检验方法.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2→H2SiO3 | B. | Al→AlO2- | C. | Na2CO3→NaOH | D. | Fe→Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中学化学中常见的物质之间的转化关系如下图所示(有些反应中的部分物质和条件被略去).在通常状况下,A为黑色金属氧化物的固体;B为无色有刺激性气味的气体,且其水溶液呈碱性;C、D均为无色的气体单质,C具有助燃性,D是大气中含量最多的物质;E为紫红色的金属单质,其硫酸盐常用于游泳池水的杀菌消毒剂.
中学化学中常见的物质之间的转化关系如下图所示(有些反应中的部分物质和条件被略去).在通常状况下,A为黑色金属氧化物的固体;B为无色有刺激性气味的气体,且其水溶液呈碱性;C、D均为无色的气体单质,C具有助燃性,D是大气中含量最多的物质;E为紫红色的金属单质,其硫酸盐常用于游泳池水的杀菌消毒剂. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HCO3-)=c(CO32-) | B. | 溶液中无H2CO3 | ||
| C. | c(HCO3-)恒定不变 | D. | 溶液中H2CO3、HCO3-、CO32-共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
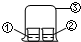 用图中所示的装置进行实验,实验现象与预测不一致的是( )
用图中所示的装置进行实验,实验现象与预测不一致的是( )| ①中的物质 | ②中的物质 | 预测现象 | |
| A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
| B | 浓氨水 | 浓盐酸 | ③中有白烟 |
| C | 浓硝酸 | 淀粉KI溶液 | ②中溶液无明显变化 |
| D | 浓盐酸 | 酚酞溶液 | ②中溶液无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙一定是弱碱 | B. | 甲一定是强碱 | C. | 乙一定是二元碱 | D. | 甲一定是一元碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| B. | “NO2球”浸泡在冷水中,颜色变浅:2NO2(g)???N2O4(g)△H<0 (红棕色) (无色) | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO${\;}_{3}^{-}$═3Fe3++2NO↑+4H2O | |
| D. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO${\;}_{3}^{2-}$+H2O?HCO${\;}_{3}^{-}$+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com