
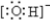 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.分析 (1)常温下,0.1mol/L X溶液的pH=13,X应为强碱,为NaOH,A由第三周期2种元素组成,可连续与NaOH反应,则B应为Al(OH)3,A为AlCl3,C为NaAlO2;
(2)常温下A、B、C、X均为气态物质,1molA中含有共价键的数目约为1.806×1024,应为NH3,X为单质,应为O2,B为NO,C为NO2.
解答 解:(1)常温下,0.1mol/L X溶液的pH=13,X应为强碱,为NaOH,A由第三周期2种元素组成,可连续与NaOH反应,则B应为Al(OH)3,A为AlCl3,C为NaAlO2,Al位于元素周期表第三周期ⅢA族,OH-离子的电子式为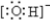 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O,
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O,
故答案为:第三周期ⅢA族;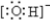 ;Al(OH)3+OH-=AlO2-+2H2O;
;Al(OH)3+OH-=AlO2-+2H2O;
(2)常温下A、B、C、X均为气态物质,1molA中含有共价键的数目约为1.806×1024,应为NH3,X为单质,应为O2,B为NO,C为NO2,
A与X反应生成B的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
在一定条件下,A可与C反应消除C对大气的污染,该反应的化学方程式是8NH3+6NO2=7N2+12H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;8NH3+6NO2=7N2+12H2O.
点评 本题考查无机物的推断,题目难度不大,注意把握题给信息,根据转化关系判断反应的特点,结合物质的构成和性质推断物质的种类.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
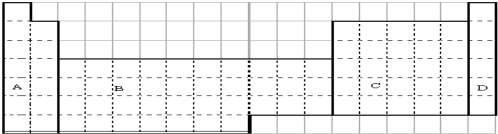
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 热稳定性:PH3>H2S>HCl>H2O | D. | 非金属性:F>O>Cl>Br>I>S |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
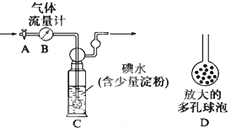 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲中的每个小黑点表示1个电子 | |
| B. | 图乙表示1s电子只能在球体内出现 | |
| C. | 图乙表明1s轨道呈球形,有无数对称轴 | |
| D. | 不同能层的s轨道平均半径都一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
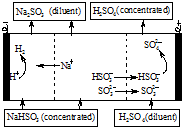 用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )
用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )| A. | 阳极区酸性增强 | |
| B. | diluent和concentrated的中文含义为浓缩的、稀释的 | |
| C. | 阴极区连接的是阳离子交换膜 | |
| D. | 该过程中的副产品主要为H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com