
在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.1 mol·L-1。向该混合液中加入1.92 g铜粉,加热,待充分反应后,设溶液的体积仍为100 mL,则所得溶液中的
Cu2+的物质的量浓度是( )
A.0.15 mol·L-1 B.0.225 mol·L-1 C.0.35 mol·L-1 D.0.45 mol·L-1
科目:高中化学 来源: 题型:
a、b、c、d、e是同周期的五种元素,a和b最高价氧化物对应的水化物呈碱性,且碱性b>a,c 和d的气态氢化物的稳定性c>d;五种元素的原子得失电子后形成的简单离子中 e半径最小,下列叙述中正确的是( )
A 原子序数关系是b <a< d< c< e B. 离子半径关系是d >c> e> b> a
C. 原子半径关系是b> a> e> d >c D. 最外层电子数关系为c >d > a >b>e
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,下列说法正确的是 ( )
A.X、Y、Z中,只有Y能使湿润的淀粉碘化钾试纸变蓝
B.1molY或Z与足量水完全反应时,均转移2mol电子
C.Z为离子化合物,但含有非极性键,阴、阳离子个数比为1:2
D.X和Y均能用向上排空气法和排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
已知
| 共价键 | H—H | Cl—Cl | H—Cl |
| 键能/kJ·mol-1 | Q1 | Q2 | Q3 |
下列关系正确的是( )
A. Q1 +Q2>Q3 B.Q1 +Q2>2Q3 C. Q1 +Q2<Q3 D.Q1 +Q2<2Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
某氮肥厂氨氮废水中氮元素多以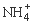 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:
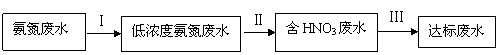

(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用
(2)过程Ⅱ:在微生物作用的条件下,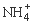 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

第一步反应是 反应(选填“放热”或“吸热”),判断依据是
。1 mol 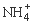 (aq)完全转化成
(aq)完全转化成  (aq)共与环境交换了 kJ热量。
(aq)共与环境交换了 kJ热量。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是
查看答案和解析>>
科目:高中化学 来源: 题型:
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是( )
A.蒸馏常用于分离提纯液态有机混合物
B.燃烧法是研究确定有机物成分的有效方法
C.核磁共振氢谱通常用于分析有机物的相对分子质量
D.对有机物分子红外光谱图的研究有助于确定有机物分子中的基团
查看答案和解析>>
科目:高中化学 来源: 题型:
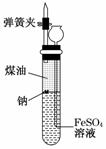 有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应的实质。实验时,往100 mL大试管中先加40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4 溶液使煤油的液面升至胶塞,并夹紧弹簧夹(如图)。
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应的实质。实验时,往100 mL大试管中先加40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4 溶液使煤油的液面升至胶塞,并夹紧弹簧夹(如图)。
仔细观察,回答下列问题:
(1)有关钠的现象:________________________________________________。
(2)大试管中溶液颜色的变化:_______________________________________________。
(3)装置中液面的变化:大试管内________;长颈漏斗内__________________________。
(4)写出钠与硫酸亚铁反应的离子方程式:_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com