
分析 根据N原子守恒:c平衡(N2O5)+c平衡(N2O3)+c平衡(N2O)=c起始(N2O5),根据O原子守恒:5c平衡(N2O5)+3c平衡(N2O3)+c平衡(N2O)+2c平衡(O2)=5c起始(N2O5),联立方程计算平衡时N2O5、N2O的平衡浓度,N2O5的转化率=$\frac{{N}_{2}{O}_{5}浓度变化量}{{N}_{2}{O}_{5}起始浓度}$×100%.
解答 解:N2O5的起始浓度为:$\frac{2.5mol}{0.5L}$=5mol/L,
根据N原子守恒:c平衡(N2O5)+c平衡(N2O3)+c平衡(N2O)=c起始(N2O5),即:
c平衡(N2O5)+1.6mol/L+c平衡(N2O)=5mol/L,
根据O原子守恒:5c平衡(N2O5)+3c平衡(N2O3)+c平衡(N2O)+2c平衡(O2)=5c起始(N2O5),即:
5c平衡(N2O5)+3×1.6mol/L+c平衡(N2O)+2×4.4mol/L=5×5mol/L,
联立方程解得:c平衡(N2O5)=2mol/L、c平衡(N2O)=1.4mol/L,
(1)N2O5的转化率为:$\frac{5mol/L-2mol/L}{5mol/L}$×100%=60%,
答:N2O5的分解率是60%;
(2)根据分析可知,N2O的平衡浓度是1.4mol/L,
答:N2O的平衡浓度是1.4mol/L.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4。W?的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是
A. 原子半径大小:X<Y,Z>W
B. X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
C. 化合物Z2Y和ZWY3都只存在离子键
D. Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
下列关于金属钠的叙述错误的是( )
A.钠的还原性很强,只能以化合态存在于自然界
B.钠质地柔软,可用小刀切割,保存在煤油中
C.钠失火后可用大量水或泡沫灭火器扑灭
D.钠的焰色反应为黄色,可用在雾天做指示灯
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,Z元素在周期表中的位置为第三周期第ⅥⅠA族族,能否用下面的反应证明Z的非金属性比碳强:2HCl+Na2CO3=NaCl+H2O+CO2↑否(填“能”或“否”)
,Z元素在周期表中的位置为第三周期第ⅥⅠA族族,能否用下面的反应证明Z的非金属性比碳强:2HCl+Na2CO3=NaCl+H2O+CO2↑否(填“能”或“否”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
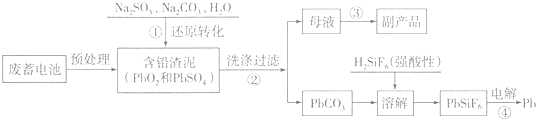
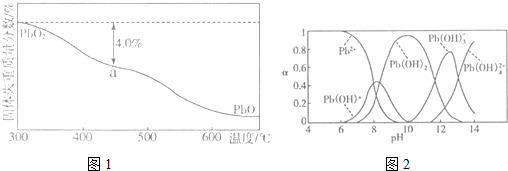
| 离子/(mol.L-1) | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度 | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度 | 0.004 | 22.6 | 0.040 | 0.053 | 49.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
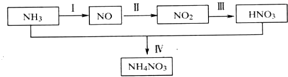

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 溶液 | 粒子浓度关系 |
| A | CH3COOK溶液中加入少量NaNO3固体后 | c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| B | 新制氯水 | c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C | NH4HSO4溶液 | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) |
| D | 0.1mol•L-1,pH为4的NaHB溶液 | c(HB-)>c(H2B)>c(B2-) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com