
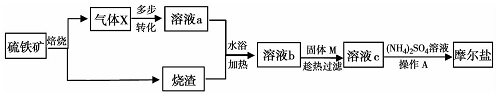
分析 粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质的除杂方法:先将混合物溶解,后过滤除泥沙,再加入试剂分别将Ca2+、Mg2+、SO42-除去,加试剂时碳酸钠一定放在氯化钡的后面,氢氧化钠和氯化钡的顺序无要求,在粗盐提纯时,加入过量的氯化钡的目的是除去硫酸根离子,并将之除尽,加入过量的NaOH溶液时为了把溶液中的Mg2+除去、溶液中的Ca 2+、过量的Ba2+通过加入Na2CO3溶液除去,最后溶液中的OH-、CO32-用稀盐酸除去,以此解答该题.
解答 解:(1)BaCl2溶液是用来除SO42-,在不引入新的杂质离子的条件下可用Ba(OH)2溶液,而Ba(NO3)2溶液会引入新的杂质离子,不可用,故答案为:B;
(2)溶液中的Ca 2+、过量的Ba2+需要除去,通过加入Na2CO3溶液除去它们,故答案为:除去Ca 2+、过量的Ba2+;
(3)粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质的除杂方法:先将混合物溶解,后过滤除泥沙,再加入试剂分别将钙离子、镁离子以及钙离子除去,但是碳酸钠一定放在氯化钡的后面,氢氧化钠和氯化钡的顺序无要求,所以顺序可以为NaOH、BaCl2、Na2CO3或 BaCl2、Na2CO3、NaOH,
故答案为:NaOH、BaCl2、NaCO3或 BaCl2、NaCO3、NaOH;
(4)氯化钡过量时,加入硫酸会产生白色沉淀,要判断SO42-是否已除尽,可以通过检验加入氯化钡溶液来确定,操作是:取上层少量清液,滴加BaCl2溶液,若无白色沉淀生成则已经除尽,故答案为:取上层少量清液,滴加BaCl2溶液,若无白色沉淀生成则已经除尽.
点评 本题考查混合物分离提纯,为高频考点,把握元素化合物知识、除杂的原则及试剂加入顺序为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X的简单阴离子与Y的简单阳离子半径:X<Y | |
| B. | X分别与Z、W、Q形成的最简单化合物的稳定性:Z<W<Q | |
| C. | ZQ3分子中的所有原子最外层均满足8电子结构 | |
| D. | W、Q形成的含氧酸均为强酸. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打可以与胃酸反应,可用小苏打治疗胃酸过多 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果发生了加成反应 | |
| C. | 食品脱氧剂(含铁粉、氯化钠、炭粉等)的脱氧原理与钢铁的吸氧腐蚀相同 | |
| D. | 加人足量氢氧化钠溶液共热.能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭 | |
| B. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| C. | 晚上在家闻到一股浓重的煤气味,赶紧开灯检查一下 | |
| D. | 浓硫酸溅到皮肤上,立即用稀氢氧化钠溶液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+ )>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol/L pH为3的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH- )=c(H+) | |
| D. | c(NH4+ )相等的(NH4)2SO4溶液、(NH4)2Fe (SO4)2溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2Fe (SO4)2]<c(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
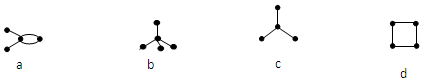
| A. | a和d是同分异构体 | B. | b和c是同系物 | ||
| C. | a和d都能发生加成反应 | D. | 只有a能使使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 金属 | 实验操作 | 实验现象 |
| 甲 | ①取少量粉末,加入过量浓硝酸 ②向上述溶液中加入几滴NaCl溶液 | 粉末溶解,有红棕色气体产生 有白色沉淀生成 |
| 乙 | ③取少量粉末,加入足量NaOH溶液 ④向上述溶液中逐滴加入稀盐酸 ⑤继续加入过量的稀盐酸 | 粉末溶解,有气泡产生 有白色沉淀生成 白色沉淀溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com