
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 3:2 |
分析 在3NO2+H2O═2HNO3+NO的反应中,氮元素由+4价升高为+5价,被氧化;氮元素由+4价降低为+2价,被还原,根据电子转移守恒,判断被氧化的氮原子与被还原的氮原子数之比.
解答 解:在3NO2+H2O═2HNO3+NO的反应中,氮元素由+4价升高为+5价,被氧化;氮元素由+4价降低为+2价,被还原,
根据电子转移守恒,可知被氧化的氮原子与被还原的氮原子物质的量之比为(4-2):(5-4)=2:1,
故选A.
点评 本题考查氧化还原反应基本概念与计算,侧重学生的分析、计算能力的考查,难度中等,关键根据化合价变化判断氧化剂与还原剂,再根据电子转移守恒判断被氧化的氮原子与被还原的氮原子物质的量之比.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
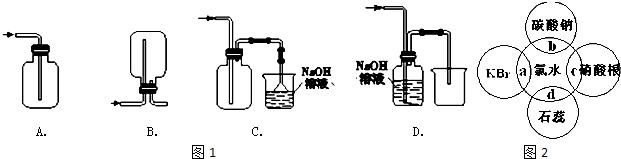
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 243 | 193 | 151 | 436 | 565 | 431 | 363 | 297 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

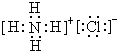
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
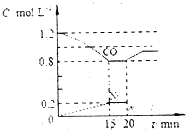 CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题
CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
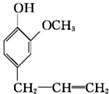 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: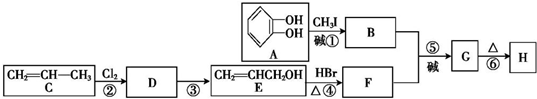
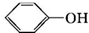 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$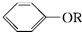 +HX(X代表卤素原子);
+HX(X代表卤素原子);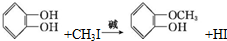 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①② | C. | ③④ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com