
| 物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
| Ksp(单位略) | 1.1×10-11 | 2.3×10-3 | 1.8×10-10 | 1.9×10-12 |
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将O.001 mol•L-1的AgN03溶液滴入O.001 mol•L-1的KCl和O.001 mol•L-1 的K2CrO4混合溶液中.先产生Ag2Cr04沉淀 | |
| C. | 0.ll mol•L-1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
分析 A、根据Ksp(CH3COOAg)=c(CH3COO-)×c(Ag+)计算;
B、根据Ksp(AgCl)以及Ksp(Ag2CrO4),当离子的浓度幂之积大于溶度积时,生成沉淀;
C、根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)计算;
D、Ksp(AgCl)只受温度的影响.
解答 解:A、等体积混合浓度均为0.2mol•L-1,c(CH3COO-)×c(Ag+)=0.04>2.3×10-3,一定产生CH3COOAg沉淀,故A不选;
B、将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,c(Ag+)×c(Cl-)=10-6,c2(Ag+)×c(CrO42-)=10-9,AgCl先达到饱和,应先生成AgCl沉淀,故B选;
C.Ksp〔Mg(OH)2〕=c(Mg2+)×c2(OH-),c(OH-)≥$\sqrt{\frac{1.1×1{0}^{-11}}{0.11}}$=10-5 mol•L-1,溶液的pH至少要控制在9以上,故C不选;
D.Ksp(AgCl)只受温度的影响,与浓度无关,故D不选.
故选B.
点评 本题综合考查难溶电解质的溶解平衡,侧重于计算,题目难度中等,注意把握计算公式的应用易错选A.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加人Na2SO4固体,c(Ba2+)增大 | |
| C. | 含1molKOH的溶液与lmolCO2完全反应后,溶液中c(K+ )=c (HCO3- ) | |
| D. | 改变条件使醋酸溶液中的醋酸根离子浓度增大,溶液的pH值可能减小也可能增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
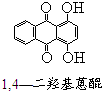 芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯(
芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯( )为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示).
)为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示). .
.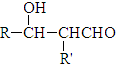 $\stackrel{△}{→}$
$\stackrel{△}{→}$
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙、丙、丁 |
| ① | 常见干燥剂 | 浓硫酸、石灰石、碱石灰 |
| ② | 常见合金 | 不锈钢、青铜、生铁 |
| ③ | 基本营养物质 | 蛋白质、维生素、糖类 |
| ④ | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
| ⑤ | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
| ⑥ | 弱电解质 | 醋酸、一水合氨、水 |
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯分子中含有双键数 | |
| B. | 1mol CaC2固体中含阴离子总数 | |
| C. | 1L 1mol/L CH3COOH溶液中所含分子总数 | |
| D. | 1mol Cl2参加化学反应获得的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液中滴加过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 金属铜与浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 实验室制备氢氧化铁胶体:Fe3++3H2O═Fe(OH)3(胶体)+3H+ | |
| D. | 向苯酚钠溶液中通入少量的二氧化碳气体:2C6H5ONa+CO2+H2O═2C6H6O+Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com