
| A、一定有甲烷 |
| B、一定有乙烯 |
| C、可能有乙烷 |
| D、一定是甲烷和乙烯的混合物 |
| 4.48L |
| 22.4L/mol |
| 3.6g |
| 18g/mol |
| 4.48L |
| 22.4L/mol |
| 3.6g |
| 18g/mol |


科目:高中化学 来源: 题型:
| A、强氧化剂与强还原剂一定能发生氧化还原反应 |
| B、为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化 |
| C、5mL98%的浓硫酸加水稀释至50mL,硫酸的质量分数大于9.8% |
| D、1molCl2参加化学反应获得的电子数都是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定 |
| B、某病人静脉滴注生理盐水后,血液被稀释,会导致c(H+)显著减小,pH显著增大,可能会引起碱中毒 |
| C、当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定 |
| D、在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离的c(H+):①=②>③=④ |
| B、将①、④两种溶液混合后,若pH=7,则消耗溶液的体积:①>④ |
| C、①②的导电性不同,③④的导电性也不同 |
| D、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
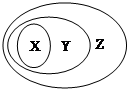
| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 酸、碱、盐 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
| B、相同 pH的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| C、0.1 mol?L-1的NaHA溶液pH=5,则溶液中:c(HA-)>c(H+)>c(A2-)>c(H2A) |
| D、向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol?L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
| A、该反应转化较快,具有存实际意义 |
| B、催化转化器在冬季时对废气转化效率比夏季更高 |
| C、2s末的反应速率v(NO)=3.75×10-4mol?L-1?S1 |
| D、在该温度下,反应的平衡常数K=5000 |
查看答案和解析>>
科目:高中化学 来源: 题型:
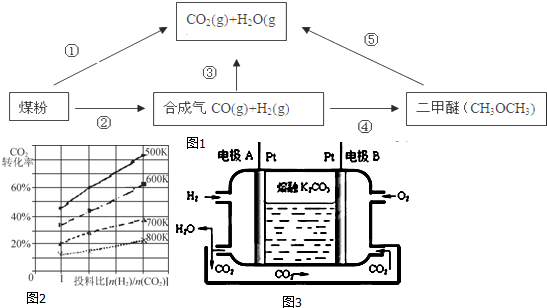
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2 |
| B、H2SO4 |
| C、NaOH |
| D、AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com