
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ④ | |||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
 .②形成的最高价氧化物的结构式O=C=C.
.②形成的最高价氧化物的结构式O=C=C.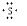 +
+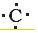 +
+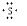 →
→ .
. 分析 根据各元素在周期表中的相对位置可知,①为Li、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl元素,
(1)非金属性越强,最高价含氧酸的酸性越强,金属性越强,最高价氧化物的水化物的碱性越强;
(2)⑤⑦形成化合物为硫化钠,硫化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;②形成的最高价氧化物为二氧化碳,二氧化碳为直线型结构,分子中含有两个碳氧双键;
(3)氧化铝为两性氧化物;氧化铝与氢氧化钠反应生成偏铝酸钠和水;
(4)Al与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(5)⑦的单质为S单质,②和⑦可形成原子数1:2的液态化合物甲为CS2,二硫化碳为共价化合物,用电子式形成二硫化碳的形成过程.
解答 解:根据各元素在周期表中的相对位置可知,①为Li、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl元素,
(1)同周期自左而右金属性减弱、非金属性最强,而同主族自上而下金属性增强、非金属性减弱,则非金属性最强的为Cl,则酸性最强的化合物的名称为高氯酸;金属性最强的为Na,则最高价氧化物的水化物碱性最强的是NaOH,
故答案为:高氯酸; NaOH;
(2)⑤⑦形成化合物为硫化钠,硫化钠为离子化合物,钠离子直接用离子符号表示,硫离子需要标出所带电荷及最外层电子,硫化钠正确的电子式为 ;
;
②形成的最高价氧化物为CO2,二氧化碳为直线型结构,分子中含有两个碳氧双键,其结构式为O=C=C,
故答案为: ;O=C=C;
;O=C=C;
(3)Al的氢氧化物具有两性,Al与NaOH反应生成偏铝酸钠和氢气,反应的离子反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Al; Al(OH)3+3H+=Al3++3H2O;
(4)⑥的单质为Al,⑤的最高价氧化物的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(5)二硫化碳是硫原子和碳原子之间通过共价键形成的共价化合物,用电子式表示其形成过程为: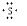 +
+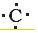 +
+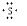 →
→ ,
,
故答案为: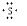 +
+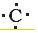 +
+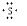 →
→ .
.
点评 本题考查位置、结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | 离子晶体 | B. | 原子晶体 | C. | 分子晶体 | D. | 金属晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池充电时,阳极固体质量增大 | |
| B. | 0.1mol•L-1CH3COONa溶液加热后,溶液的pH减小 | |
| C. | 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023个 | |
| D. | 室温下,稀释0.1mol•L-1氨水c(H+).c(NH3•H2O)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 盛放氢氧化钠溶液的试剂瓶用橡胶塞 | 氢氧化钠可以与玻璃中的二氧化硅反应生成粘性的硅酸钠 | Ⅰ对,Ⅱ错,无 |
| B | 氯水可以使有色布条褪色 | 氯气具有漂白性 | Ⅰ错,Ⅱ对,有 |
| C | 二氧化硅可以与水反应生成硅酸 | 二氧化硅是酸性氧化物具有酸性氧化物的通性 | Ⅰ对,Ⅱ对,无 |
| D | 为增强漂白能力使用漂白粉时向漂白粉溶液中加入少量白醋 | 醋酸的酸性比次氯酸强 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10 个中子的氧原子:${\;}_{8}^{18}$O | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | CO2的比例模型: | |
| D. | 溴化铵的电子式: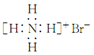 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,56g由N2和CO组成的混合气体含有的原子数目为4 NA | |
| B. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数为0.3NA | |
| C. | 1 L 1.0mol•L-1的NaAlO2水溶液中含有的总原子数为2NA | |
| D. | 1 mol羟基中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 预测的实验现象 | 实验结论或解释 | |
| A | 向饱和Na2CO3 溶液中滴加少量稀盐酸 | 立即有气体逸出 | CO32-+2H+═H2O+CO2↑ |
| B | 将浓硫酸滴加到盛有铜片的试管中,并将 蘸有品红溶液的试纸置于试管口 | 品红试纸褪色 | SO2具有漂白性 |
| C | 铝箔在酒精灯火焰上加热 | 铝熔化但不会滴下 | A12O3的熔点比铝高 |
| D | 向淀粉的酸性水解液中滴入少量新制 Cu (OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
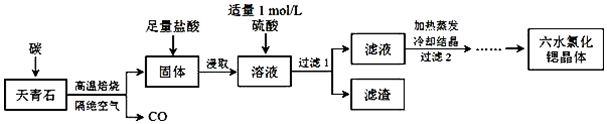
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com