
| A. | ${\;}_{29}^{64}$Cu 的核电荷数为 29 | B. | ${\;}_{29}^{64}$Cu 的质子数为 35 | ||
| C. | ${\;}_{29}^{64}$Cu 的中子数为 64 | D. | ${\;}_{29}^{64}$的核外电子数为 64 |
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 H2O2$\frac{\underline{\;催化剂\;}}{\;}$2 H2O+O2↑ | B. | 2 Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3 H2O | ||
| C. | Fe2O3+3 CO$\frac{\underline{\;高温\;}}{\;}$2 Fe+3 CO2 | D. | Cl2+H2O═HCl+HclO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
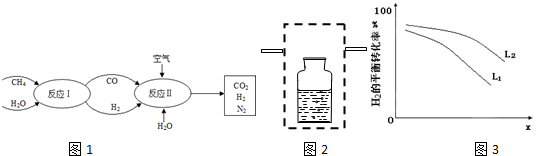
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电能是一级能源 | B. | 水煤气是二级能源 | ||
| C. | 天然气是二级能源 | D. | 水能是二级能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | C>A>D>B | C. | A>C>D>B | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;NH3的稳定性比PH3的强(填“强”或“弱”).
;NH3的稳定性比PH3的强(填“强”或“弱”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 1mol/L的NaCl溶液 | B. | 150 mL 1mol/L的MgCl2溶液 | ||
| C. | 100mL 1mol/L的HCl溶液 | D. | 50mL 1mol/L的AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com