
关于下列各图的叙述正确的是
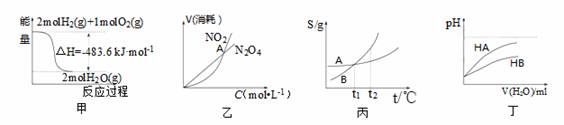 |
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
科目:高中化学 来源: 题型:
下列离子方程式中,属于水解反应的是
A.H2SO3+H2O HSO3- + H3O+ B.CO32— + H2O
HSO3- + H3O+ B.CO32— + H2O HCO3— + OH—
HCO3— + OH—
C.NH3·H2O NH4+ +OH- D.HS— + H2O
NH4+ +OH- D.HS— + H2O S2— + H3O+
S2— + H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
“天蓝蓝海蓝蓝,海边小城威海卫”。威海海水资源丰富,回答下列问题:
(1)海水中主要含有 等离子(写离子符号,至少答出4种)。
(2)海水脱硫是一种有效除去火力发电产生的SO2的方法。其工艺流程如下图所示:
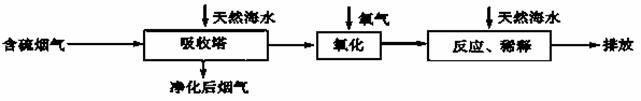
天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是: ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 。
(3)下图是海水综合利用的一个方面。

请回答下列问题:
I.①步主要反应的离子方程式: 。
溴及其化合物的用途有很多,写出其中的一种 。
II.第③步需要加入 ,其前面分离出氢氧化镁的操作称为 ,将镁条在二氧化碳中燃烧的产物为 。
III.粗盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤 正确的操作顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法正确的是
A.1mol乙酸和1mol乙醇充分反应生成的水分子数为NA
B.6.8g液态KHSO4中含有0.1NA个阳离子
C.标况下的NO2气体22.4L,其中含有的氮原子数为NA
D.常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学—物质结构与性质(15分)
化学—物质结构与性质(15分)
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2与水反应生成乙炔的反应方程式为________.
(2)比较第二周期元素C、N、O三种元素的第一电离能从大到小顺序为 ______(用元素符号表示),用原子结构观点加以解释______。
(3)CaC中C22-与O22+互为等电子体,O22+的电子式可表示为______;1molO22+中含有的Π键数目为_______。
(4)CaC2晶体的晶胞结构与NaCI晶体的相似(如图所示),
但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个
方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-
数目为______。
(5)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。
Cu+基态核外电子排布式为 _______。
(6)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈
分子中碳原子轨道杂化类型是______;分子中处于同一
直线上的原子数目最多为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0
2Z(g);ΔH<0

上图表示该反应的速率(v)随时间(t)的变化关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时增大了压强 B.t3时降低了温度
C.t5时升高温度 D.t6时反应物的转化率比t4时高

查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,有一种叫Thibacillus Ferroxidans 的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐,发生的反应为:
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中的Fe的化合价为+2,则被氧化的元素为
(2)工业上生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
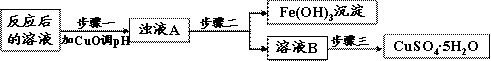 |
①分析下列表格(其中Ksp是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
步骤一应调节溶液的pH范围是 ,请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因
 ②步骤三中的具体操作方法是
②步骤三中的具体操作方法是
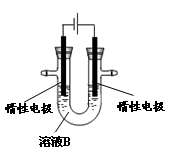
(3)有人提出可以利用如图的装置从溶液B中提炼金属铜。该过程中右边电极的反应式是 ,若装入B溶液500mL(电解前后溶液体积变化可忽略),当阴极增重1.6g时,停止通电,则反应后溶液的pH= 。
(4)工业上冶炼铜的方法之一为:
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) ΔH
已知:①2Cu(s)+1/2O2(g)=Cu2O(s) ΔH=-12kJ/mol
②2Cu(s)+S(s)=Cu2S(s) ΔH=-79.5kJ/mol
③S(s)+O2(g)=SO2(g) ΔH=-296.8kJ/mol
则该法冶炼铜的反应中ΔH= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com