
����Ŀ�����Բ���A��������Ԫ����ɵĻ����ij�о�С�鰴��ͼ����̽������ɣ� 
��ش�
��1��A�Ļ�ѧʽΪ �� A��������B��E�Ļ�ѧ����ʽΪ ��
��2����ҺC���ܽ�ͭƬ����Ӧ�����ӷ���ʽΪ �� ���ٸ÷�Ӧ��һ��ʵ��Ӧ����
��3����֪������A����ϡ���ᷴӦ������һ�ֵ���ɫ�������һ�����壨����µ��ܶ�Ϊ1.518g/L������������ӵĵ���ʽΪ �� �÷�Ӧ�����ӷ���ʽΪ ��
���𰸡�
��1��Fe3S4��4Fe3S4+25O2 ![]() 6Fe2O3+16SO2
6Fe2O3+16SO2
��2��2Fe3++Cu=2Fe2++Cu2+������ͭ��·��
��3��![]() ��Fe3S4+6H+=3Fe2++S+3H2S��
��Fe3S4+6H+=3Fe2++S+3H2S��
���������⣺��1�������Ϸ�����֪��AΪFe3S4 �� BΪFe2O3 �� EӦΪSO2 �� ��A��������B��E�Ļ�ѧ����ʽΪ4Fe3S4+25O2 ![]() 6Fe2O3+16SO2 �� ���Դ��ǣ�Fe3S4��4Fe3S4+25O2
6Fe2O3+16SO2 �� ���Դ��ǣ�Fe3S4��4Fe3S4+25O2 ![]() 6Fe2O3+16SO2����2�������Ϸ�����֪����ҺCΪFeCl3 �� ������ͭ�������ڿ���ͭ��·�壬��Ӧ�����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+ ��
6Fe2O3+16SO2����2�������Ϸ�����֪����ҺCΪFeCl3 �� ������ͭ�������ڿ���ͭ��·�壬��Ӧ�����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+ ��
���Դ��ǣ�2Fe3++Cu=2Fe2++Cu2+������ͭ��·�壻��3��������A����ϡ���ᷴӦ������һ�ֵ���ɫ�������һ�����壨����µ��ܶ�Ϊ1.518gL��1��������ɫ������ΪS���������Է�������Ϊ1.518��22.4L=34��ΪH2S���壬����ʽΪ ![]() ����Ӧ�����ӷ���ʽΪFe3S4+6H+=3Fe2++S+3H2S����
����Ӧ�����ӷ���ʽΪFe3S4+6H+=3Fe2++S+3H2S����
���Դ��ǣ� ![]() ��Fe3S4+6H+=3Fe2++S+3H2S����
��Fe3S4+6H+=3Fe2++S+3H2S����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ҹ��Ļ������ߡ�����������Ӧ���ᳫ����
A. ��ȡ��̼���ڼ�����ʽ
B. ���չ涨�������������з������
C. ����ũ���������������֪ʶ
D. ����ʹ��һ���Կ��ӡ�ֽ�������ϴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�Ħ������������
A. 10mlH2O B. 0��8molH2SO4 C. 54gAl D. 1gCaCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������գ�
��1������FeCl3��Һʴ��ͭ�������·��Ĺ����У���Һ������Fe2+��Fe3+��Cu2+����������Դ���պ������壮�������洦���������ش��������⣺ 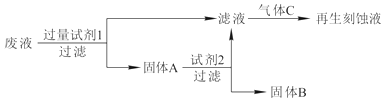
�Լ�2�� �� ����B�� �� ͨ��������C�� �� ���ѧʽ����
��2��д�������Լ�1������Ӧ�����ӷ���ʽ���� ��
��3�����ۺ����ú�ˮ�����Ʊ�ʳ�Ρ��������þ�����ʣ�����������ͼ��ʾ�� 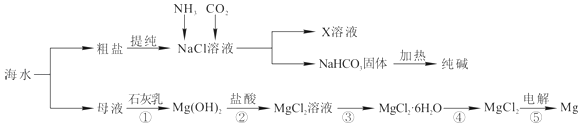
��Ӧ�٩����У�����������ԭ��Ӧ����������ţ���
��4��д����Ӧ�ڵ����ӷ���ʽ ��
��5��X��Һ�е���Ҫ��������Na+�� ��
��6�������к���Na2SO4��MgCl2��CaCl2�ȿ��������ʣ�Ϊ�Ƶô�����NaCl���壬�������£����ܽ⣻�����μ��������BaCl2��Һ��NaOH��Һ��Na2CO3��Һ�������ܼ�������������벹ȫȱ�ٵ�ʵ�鲽�裩��
��7�����鴿����Ʒ���Ƿ�NaClӦѡ�õ��Լ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���л�ѧ��Ӧ�����ӷ���ʽ����(����)
A.����������Һ��ϡ���ᷴӦ��OH-+H��=H2O
B.�����ʯ��ˮ��ϡ���ᷴӦ��Ca(OH)2+2H��=Ca2��+2H2O
C.����������������Һ��Ӧ��H��+OH-=H2O
D.̼�ᱵ����ϡ�����У�CO32-+2H��=H2O+CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Fe��ȥ��ˮ���е������Σ�NO3�����ѳ�Ϊ�������о����ȵ�֮һ��
��1��Fe��ԭˮ����NO3���ķ�Ӧԭ����ͼ1��ʾ�� 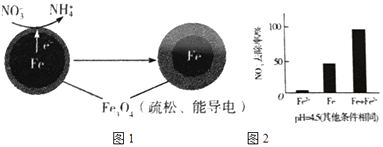
���������������� ��
�������ĵ缫��Ӧʽ�� ��
��2������������Ͷ��ˮ���У���24Сʱ�ⶨNO3����ȥ���ʺ�pH����������
��ʼpH | pH=2.5 | pH=4.5 |
NO3����ȥ���� | �ӽ�100% | ��50% |
24СʱpH | �ӽ����� | �ӽ����� |
��������������̬ |
|
|
pH=4.5ʱ��NO3����ȥ���ʵͣ���ԭ���� ��
��3��ʵ�鷢�֣��ڳ�ʼpH=4.5��ˮ����Ͷ���������۵�ͬʱ������һ������Fe2+�����������NO3����ȥ���ʣ���Fe2+������������ּ��裺
��Fe2+ֱ�ӻ�ԭNO3����
��Fe2+�ƻ�FeO��OH�������㣮
�����Ա�ʵ�飬�������ͼ2��ʾ���ɵõ��Ľ����� ��
��ͬλ��ʾ�ٷ�֤ʵFe2+����FeO��OH����Ӧ����Fe3O4 �� ��ϸ÷�Ӧ�����ӷ���ʽ�����ͼ���Fe2+���NO3��ȥ���ʵ�ԭ�� �� pH=4.5������������ͬ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ20mL���������Ļ��Һ�壬����������Ȼ�����Һ������4.66g��ɫ������Ȼ���������Һ�м���ag�����������ۣ���������������Ϊ896mL����״���£���
��1��д�����������з��������ӷ���ʽ ��
��2������ԭ���Һ���У��������ʵ���Ũ����mol/L���������ʵ���Ũ����mol/L��д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к��д�����Cl����Br����I�� �� ����1L�û����Һ��ͨ��һ������Cl2 �� ��Һ��Cl����Br����I�������ʵ�����ͨ��Cl2���������״�����Ĺ�ϵ���±���ʾ��ԭ��Һ��Cl����Br����I�������ʵ���Ũ��֮��Ϊ��������
Cl2���������״���� | 5.6L | 11.2L | 22.4L |
n��Cl����/mol | 1.5 | 2.0 | 3.0 |
n��Br����/mol | 3.0 | 2.8 | 1.8 |
n��I����/mol | x��x��0�� | 0 | 0 |
A.5��15��4
B.5��12��4
C.15��30��8
D.�������㣬������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com