
【题目】将1.000gFeC2O42H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:
已知:①草酸盐受热分解易放出碳的氧化物.②500℃之前,该热重分析仪的样品池处于Ar气气氛中,500℃时起,样品池与大气相通.完成下列填空:
(1)300℃时是样品脱水的过程,试确定350℃时样品是否脱水完全 △ (填“是”或“否”),判断的理由是什么?(要求写出推算过程).
(2)400℃时发生变化的化学方程式是 .
(3)将600℃时样品池中残留的固体隔绝空气冷却至室温,再向该固体中加入一定量的稀盐酸刚好完全溶解,用pH试纸测得所得溶液的pH=3,其原因是(用离子方程式回答).向该溶液中滴加适量NaOH溶液,生成红褐色沉淀,测得此时溶液中铁元素的离子浓度为4.0×10﹣11 molL﹣1 , 则此时溶液的pH=(已知:Ksp[Fe(OH)2]=8.0×10﹣16 , Ksp[Fe(OH)3]=4.0×10﹣38).
(4)将1500℃时样品池中残留的固体隔绝空气冷却后,用稀盐酸溶解得一棕黄色溶液.取少量该溶液滴加KSCN,溶液显血红色;另取少量该溶液滴加K3[Fe(CN)6](铁氰化钾)溶液,产生特征蓝色沉淀.试写出图中1 400℃时发生反应的化学方程式 , 产生特征蓝色沉淀的离子反应方程式 .
【答案】
(1)是;
FeC2O42H2O ![]() FeC2O4(2﹣n)H2O+nH2O
FeC2O4(2﹣n)H2O+nH2O
180 18n
1.000g (1.000﹣0.800)g
解得n=2,所以350℃时样品完全脱水;
(2)FeC2O4 ![]() FeO+CO↑+CO2↑
FeO+CO↑+CO2↑
(3)Fe3++3H2O?Fe(OH)3+3H+;5
(4)6Fe2O3 ![]() 4Fe3O4+O2↑;3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓
4Fe3O4+O2↑;3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓
【解析】解:(1)根据图象,300℃时是样品脱水生成固体质量为0.800g,所以假设反应为:FeC2O42H2O ![]() FeC2O4(2﹣n)H2O+nH2O
FeC2O4(2﹣n)H2O+nH2O
180 18n
1.000g (1.000﹣0.800)g
解得n=2,所以350℃时样品完全脱水;
所以答案是:是;
推算过程:
FeC2O42H2O ![]() FeC2O4(2﹣n)H2O+nH2O
FeC2O4(2﹣n)H2O+nH2O
180 18n
1.000g (1.000﹣0.800)g
解得n=2,所以350℃时样品完全脱水;(2)根据铁元素质量守恒,铁原子的最小公倍数是6,于是存在下列质量关系:
6FeO→3Fe2O3→2Fe3O4
72:80:77.3
固体质量的变化趋势与表中提供的数据一致.即72:80:77.3≈0.400:0.444:0.429.
因此表明:FeC2O4分解时,先转变为FeO,再转变为Fe2O3 , 最后变为Fe3O4 , 所以400℃时FeC2O4分解生成FeO,结合化合价有升必有降,则还有一氧化碳和二氧化碳生成;反应方程式为:FeC2O4 ![]() FeO+CO↑+CO2↑;所以答案是:FeC2O4
FeO+CO↑+CO2↑;所以答案是:FeC2O4 ![]() FeO+CO↑+CO2↑;(3)根据(2)的分析,600℃时FeC2O4分解生成Fe2O3 , 加稀盐酸溶解生成三价铁溶液,因为三价铁易水解所以溶液的PH为3,水解方程式为:Fe3++3H2OFe(OH)3+3H+;当铁元素的离子浓度为4.0×10﹣11 molL﹣1 , 则氢氧根的浓度为:
FeO+CO↑+CO2↑;(3)根据(2)的分析,600℃时FeC2O4分解生成Fe2O3 , 加稀盐酸溶解生成三价铁溶液,因为三价铁易水解所以溶液的PH为3,水解方程式为:Fe3++3H2OFe(OH)3+3H+;当铁元素的离子浓度为4.0×10﹣11 molL﹣1 , 则氢氧根的浓度为: ![]() =1.0×10﹣9 molL﹣1 , 氢离子浓度为
=1.0×10﹣9 molL﹣1 , 氢离子浓度为 ![]() =1.0×10﹣5 molL﹣1 , 所以PH=5,所以答案是:Fe3++3H2OFe(OH)3+3H+;5;(4)根据取少量该溶液滴加KSCN,溶液显血红色,说明含有三价铁离子;另取少量该溶液滴加K3[Fe(CN)6](铁氰化钾)溶液,产生特征蓝色沉淀,说明含有二价铁离子,所以根据氧化还原反应的特征1 400℃时Fe2O3发生分解生成Fe3O4和氧气;产生特征蓝色沉淀的离子反应方程式3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓;所以答案是:6Fe2O3
=1.0×10﹣5 molL﹣1 , 所以PH=5,所以答案是:Fe3++3H2OFe(OH)3+3H+;5;(4)根据取少量该溶液滴加KSCN,溶液显血红色,说明含有三价铁离子;另取少量该溶液滴加K3[Fe(CN)6](铁氰化钾)溶液,产生特征蓝色沉淀,说明含有二价铁离子,所以根据氧化还原反应的特征1 400℃时Fe2O3发生分解生成Fe3O4和氧气;产生特征蓝色沉淀的离子反应方程式3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓;所以答案是:6Fe2O3 ![]() 4Fe3O4+O2↑;3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓;
4Fe3O4+O2↑;3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓;


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( ) 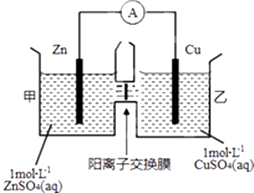
A.Zn电极上发生氧化反应
B.电子的流向为Zn→电流表→Cu
C.SO42﹣由乙池通过离子交换膜向甲池移动
D.电池工作一段时间后,乙池溶液的总质量明显增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是 ( )
A.用石灰、碳酸钠等碱性物质处理废水中的酸
B.氯气可用于自来水杀菌消毒
C.氢氧化铝可用于中和过多胃酸
D.用谷物酿造出酒和醋,酿造过程中只发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaSO4在水中的沉淀溶解平衡曲线,如图所示,向100mL该条件下的CaSO4饱和溶液中,加入400mL 0.01mol/L的Na2SO4溶液,针对此过程的下列叙述正确的是( ) 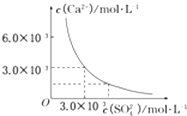
A.溶液中析出CaSO4沉淀,最终溶液中c(SO ![]() )较原来大
)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO ![]() )都变小
)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO ![]() )都变小
)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO ![]() )较原来大
)较原来大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com