
 A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.
A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.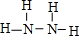 ,含有5个σ键、没有π键,故b错误;
,含有5个σ键、没有π键,故b错误;

科目:高中化学 来源: 题型:
| A、①④⑤ | B、④⑤ |
| C、④⑤⑦ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
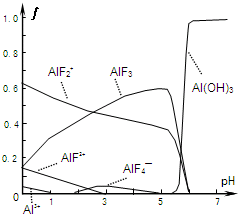 Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是
Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是| 温度/℃ | 1500 | 1800 | 2400 |
| 平衡常数K | 8.0×10-5 | 3.0×10-4 | 6.4×10-3 |
| 电离平衡常数 | |||
| 柠檬酸 | Ka1=7.1×10-4 | Ka2=1.68×10-5 | Ka3=4.1×10-7 |
| 氢氰酸 | Ka=4.93×10-10 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | Ka1 | Ka2 |
| H2C2O4 | 5.9×10-2 | 6.4×10-5 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
| H2SO3 | 1.3×10-2 | 5.6×10-8 |
| HClO | 4.7×10-10 | |
| CH3COOH | 1.6×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用电池外壳的金属材料 |
| B、不使电池中泄漏的电解液腐蚀其他物品 |
| C、回收其中石墨电极 |
| D、防止电池中汞、镉和铅等重金属离子对水和土壤的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成晶体的两种微粒电子层结构相同 |
| B、构成晶体的两种微粒半径不相等 |
| C、与盐酸反应生成盐的化学键类型相同 |
| D、与盐酸反应生成盐的晶体类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com