
下列化学实验事实及解释都正确的是( )
A.向Na2SO3溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2SO3溶液已经变质
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.等体积、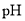 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB
都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB
D.向浓度均为0.1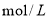 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(0H)2]>Ksp[Mg(0H)2]
的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(0H)2]>Ksp[Mg(0H)2]
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届江西南昌第二中学高三上第三次考试理综化学试卷(解析版) 题型:选择题
化学已渗透到人类生活的各个方面。下列说法正确的是
A.燃煤产生的二氧化硫是引起雾霾的主要原因
B.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
C.垃圾焚烧法已成为许多城市垃圾处理的主要方法之一,利用垃圾焚烧产生的热能发电或供热,能较充分地利用生活垃圾中的生物质能
D.为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷(解析版) 题型:选择题
某恒温密闭容器发生可逆反应:Z(?)+W(?) X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
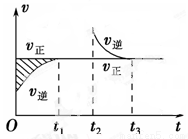
A、Z和W在该条件下均为非气态
B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的
平均摩尔质量不可能相等
C、若在该温度下此反应平衡常数表达式为K=c(X),则 t1~t2时间段与t3时刻后的 X浓度不相等
X浓度不相等
D、若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高一上月考三理化学卷(解析版) 题型:选择题
下列分离、提纯、鉴别物质的方法不正确的是( )
A、用渗析的方法除去NaCl溶液中含有的少量淀粉胶体
B、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2杂质
C、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D、用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高二上月考三化学试卷(解析版) 题型:推断题
金属冶炼和金属化合物处理常涉及氧化还原反应。
(1)若用惰性电极电解饱和NaCl溶液一段时间当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH =__________。
(2)利用反应2Cu+O2+2H2SO4=CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
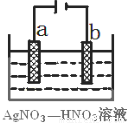
(3)右图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高一上期中考试化学试卷(解析版) 题型:选择题
根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3 + I2 + H2O = 2HI + H2SO4
2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
3FeCl2 + 4HNO3 = 2FeCl3 + NO↑+ 2H2O + Fe(NO3)3
A. H2SO3 > I- > Fe2+ > NO
B. I- > Fe2+ > H2SO3 > NO
C. Fe2+ > I- > H2SO3 > NO
D. NO >Fe2+ > H2SO3 > I-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高二上期中考试化学试卷(解析版) 题型:选择题
利尿酸在奥运会上被禁用,其结构简式如下图所示。下列叙述正确的是
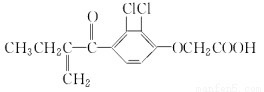
A.利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B.利尿酸分子内处于同一平面的原子不超过10个
C.1 mol利尿酸能与7 mol H2发生加成反应
D.利尿酸不能与溴水反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:选择题
在100℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,反应过程中浓度变化如下:2NO2(g)  N2O4(g) ΔH <0
N2O4(g) ΔH <0
容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
Ⅰ | N2O4 | 0.100 | 0.040 |
NO2 | 0 | 0.120 | |
Ⅱ | N2O4 | 0 | 0.014 |
NO2 | 0.100 | 0.072 |
下列说法正确的是
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2)
B. 平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ) = 2K(Ⅱ)
C. 平衡后,升高相同温度,以N2O4表示的反应速率ν(Ⅰ)<ν(Ⅱ)
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期期中(理)化学试卷(解析版) 题型:选择题
水的电离平衡曲线如图所示,下列说法不正确的是

A.图中五点KW间的关系B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=l2的KOH等体积混合后,溶液显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com