
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是

A. a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
【答案】C
【解析】A.用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2SO3溶液,a点溶液中溶质为H2SO3和NaHSO3,pH=1.85=pKa1,电离平衡常数表达式得到则c(H2SO3)=c(HSO3-),溶液体积大于20ml,a点所得溶液中:c(H2SO3)+c(SO32-)+c(HSO3-)=2c(H2SO3)+c(SO32-)<0.1molL-1 ,故A错误;B.b点是用0.1molL-1NaOH溶液20ml滴定20mL0.1molL-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),物料守恒c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),得到:c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故B错误;C.c点pH=7.19=pKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO32-+H2OHSO3-+OH-,Kh=![]() =
=![]() ,c(OH-)=
,c(OH-)=![]() ,带入计算得到:c(HSO3-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3),故C正确;D.加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1molL-1H2SO3溶液恰好反应生成Na2SO3,Na2SO3水解显碱性,溶液中离子浓度c(OH-)> c(H+),故D错误;故选C。
,带入计算得到:c(HSO3-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3),故C正确;D.加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1molL-1H2SO3溶液恰好反应生成Na2SO3,Na2SO3水解显碱性,溶液中离子浓度c(OH-)> c(H+),故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
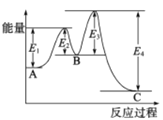
A. △H= E4- E3+E2-E1
B. 加入V2O5后反应经过两步完成,其中第一步决定反应速率
C. 加入V2O5,△H不变,但反应速率改变
D. 向密闭容器中充入2molSO2和1molO2,发生上述反应达平衡时,反应放热198kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为________________________________。
(2)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因__________________________________________。
II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
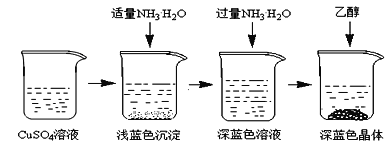
(3)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式___________________。
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是________________________。
III.氨含量的测定
精确称取wg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
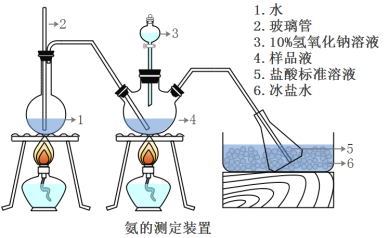
(5)A装置中长玻璃管的作用_________________,样品中氨的质量分数的表达式_______。
(6)下列实验操作可能使氨含量测定结果偏高的原因是____________________。
A.滴定时未用NaOH标准溶液润洗滴定管。
B.读数时,滴定前平视,滴定后俯视。
C.滴定过程中选用酚酞作指示剂。
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用勒夏特列原理解释的是
A. 使用铁触媒,加快合成氨反应速率
B. 溴水中存在Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
C. 合成氨工业采用20~50 MPa高压
D. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g) ΔH<0,平衡后,升高温度体系颜色变深
CO2(g)+NO(g) ΔH<0,平衡后,升高温度体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸的过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol1
2SO3(g) ΔH=196.6 kJ·mol1
B. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=98.3 kJ·mol1
2SO3(g) ΔH=98.3 kJ·mol1
C. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=+98.3 kJ·mol1
SO3(g) ΔH=+98.3 kJ·mol1
D. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=49.2 kJ·mol1
SO3(g) ΔH=49.2 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的![]()
C. 应用盖斯定律可计算某些难以直接测量的反应焓变
D. 1g碳与适量水蒸气反应生成 CO和H2,吸收10.94kJ热量,则热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
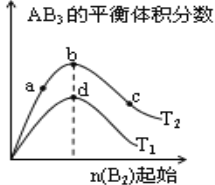
A. 若T2>T1,则正反应一定是放热反应
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2>T1,达到平衡时b、d点的反应速率为vd> vb
D. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】飞机C919是我国自行研制的,标志着我国飞机制造技术的飞跃。请回答问题:
(1)利用CO还原赤铁矿石可制得铁单质,其反应的化学方程式为____。
(2)飞机上使用的螺丝钉一般不用铁制的,其原因是因为铁与____反应易生锈。
(3)铝比铁活泼,但铝制品耐腐蚀的原因是____。
(4)航空煤油是将石油通过____(分馏或干馏)提炼出来的,飞行过程中主要是 ___能转化为机械能。
(5)C919的厨房为乘客提供了以下食物:快餐、雪碧、牛奶、蔬菜面条等。上述食物中属于溶液的是____,蔬菜面条比普通面条多提供的营养物质主要是____和矿物质。
(6)飞机急救箱中还准备消毒剂过氧化氢溶液,过氧化氢中氧元素的化合价为____。
(7)飞机上的座椅套采用耐磨、耐腐蚀的“尼龙”属于____材料。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物A,已知其中可能含有MgCl2、CuSO4、CaCO3、FeCl3四种物质中的两种或多种。按如图所示进行实验,出现的现象如图中所述(假设过程中所有发生的反应都恰好完全进行)。
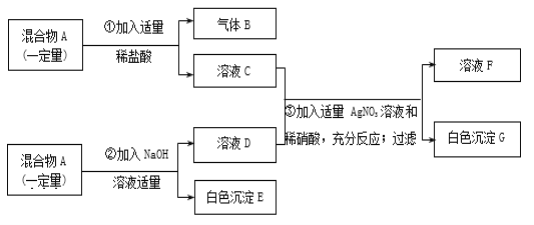
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体B的化学式为______。
(2)在混合物A里,上述四物质中肯定不存在的物质是_____(写化学式)。
(3)在溶液F中,主要含有___种溶质,其中大量含有的酸根离子符号是____。
(4)写出1个生成白色沉淀G的化学方程式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com