
【题目】向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉充分反应后,得到的固体经过滤、干燥、称重,若所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比为
A.3︰14B.1︰7C.2︰7D.3︰2
【答案】A
【解析】
向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉,发生反应Fe+CuCl2=Cu+FeCl2,Fe+Fe2(SO4)3=3FeSO4,最后固体的质量与加入的铁粉的质量相等,则反应Fe+CuCl2=Cu+FeCl2导致固体增重等于反应Fe+Fe2(SO4)3=3FeSO4中参加反应的Fe的质量,
假定反应Fe+Fe2(SO4)3=3FeSO4中参加反应的Fe的质量为56g,物质的量为![]() =1mol,由方程式可知Fe2(SO4)3的物质的量为1mol,
=1mol,由方程式可知Fe2(SO4)3的物质的量为1mol,
Fe+CuCl2=Cu+FeCl2固体增重△m
1mol 64g-56g=8g
n(CuCl2) 56g
故n(CuCl2)=![]() ×1mol=7mol,
×1mol=7mol,
故原溶液中c(SO42-):c(Cl-)=1mol×3:7mol×2=3:14,
故选A。


科目:高中化学 来源: 题型:
【题目】勒夏特列原理是自然界一条重要的基本原理,下列事实能用勒夏特列原理解释的是
A. NO2气体受压缩后,颜色先变深后变浅
B. 对2HI(g) ![]() H2(g)+I2(g)平衡体系加压,颜色迅速变深
H2(g)+I2(g)平衡体系加压,颜色迅速变深
C. 合成氨工业采用高温、高压工艺提高氨的产率
D. 配制硫酸亚铁溶液时,常加入少量铁屑以防止氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传感器可以检测空气中SO2的含量,传感器的工作原理如图所示。下列叙述中正确的是( )
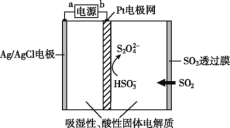
A.b为电源的正极
B.阳极的电极反应式为Ag++Cl-=AgCl
C.当电路中电子转移5×10-5 mol时,进入传感器的SO2为1.12 mL
D.阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入4 mol A,在一定温度和体积可变的密闭容器中发生如下反应:4A(g) ![]() 3B(g)+C(g);ΔH<0,达到平衡时有30%的A发生反应,下列判断正确的是
3B(g)+C(g);ΔH<0,达到平衡时有30%的A发生反应,下列判断正确的是
A. 若向密闭体系内再加入3molB、2molC,达平衡时C的百分含量与原平衡相同
B. 达到平衡时气体的总物质的量、密度都不发生变化
C. 反应达平衡的过程中,释放出的热量不发生变化
D. 升高温度A的转化率大于30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是

A.Y单质的熔点高于X单质
B.元素非金属性强弱的顺序为W>Y>Z
C.Z元素在自然界中既有游离态也有化合态
D.1moIW 和X形成的化合物中可能含有4mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿比朵尔主要用于甲、乙型流感和其它呼吸道病毒感染症的防治,有专家认为其在新冠肺炎的治疗上也有一定的疗效。阿比朵尔的合成路线如图所示:
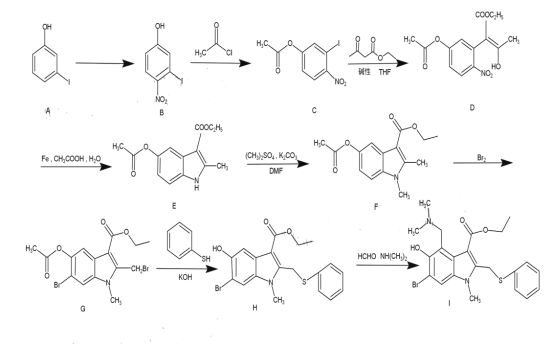
(1)图中I为阿比朵尔,其分子式为__________,
(2) A的名称是__________,G→H的反应类型为___________。
(3) C中所含的含氧官能团的名称为_____________。
(4) F→G的化学方程式为____________。
(5)C有多种同分异构体,写出能同时满足下列条件的芳香化合物的结构简式(不考虑立体异构)_________。
①能与NaHCO3溶液反应放出CO2;②核磁共振氢谱有三组峰,且峰面积的比是1:1:1。
(6)如图为合成阿比朵尔的另一种方法,请参照上述流程将下列流程图补充完整(试剂可从上题试剂中任选):______
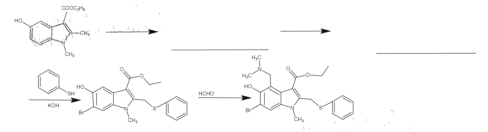
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式,下列判断正确的是
①I2(g)+H2(g) ![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
②I2(s)+H2(g) ![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
A. 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ
C. 反应②的反应物总能量比反应①的反应物总能量低
D. 当反应②吸收52.96 kJ热量时转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与工农业生产及人们的日常生活密切相关。回答下列问题:
(1)利用某废铜下脚料(主要成分是![]() )可制备硫酸铜晶体(蓝矾),制备方法如图所示:
)可制备硫酸铜晶体(蓝矾),制备方法如图所示:
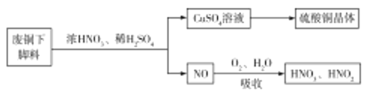
①蓝矾的化学式为:____________。
②废铜与浓硝酸,稀硫酸反应的化学方程式为______________。
(2)工业上制备尿素的反应是:![]() 。一定温度下,在容积为
。一定温度下,在容积为![]() 的恒溶液密闭容器中加入
的恒溶液密闭容器中加入![]() 和
和![]() ,反应过程中有关物质的物质的量(n)与时间的关系如图所示,
,反应过程中有关物质的物质的量(n)与时间的关系如图所示,![]() 是反应达到平衡状态。
是反应达到平衡状态。
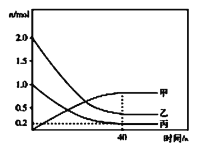
①曲线甲表示的物质是__________(写化学式)。反应开始至达到平衡时,平均反应速率![]() __________
__________![]() ,
,![]() 的平衡转化率是__________。
的平衡转化率是__________。
②升高温度,平衡__________(填“不移动”“向正反方向移动”或“向逆反应方向移动”,下同);及时从容器中分离出尿素,平衡__________。
(3)用![]() 电极作阳极可处理酸化后的亚硝酸盐污水,使
电极作阳极可处理酸化后的亚硝酸盐污水,使![]() 转化为无害气体,且溶液逐渐变为黄色,则
转化为无害气体,且溶液逐渐变为黄色,则![]() 转化为无害气体的离子方程式为__________。
转化为无害气体的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A.铝制餐具不宜长期存放酸性食物:2Al+6H+=2Al3++3H2↑
B.用NaHCO3溶液除去CO2中的HCl气体:HCO3-+H+=CO2↑ +H2O
C.口罩中无纺布纤维聚丙烯的合成:nCH3CH=CH2![]()
![]()
D.硬塑料中酚醛树脂的合成: 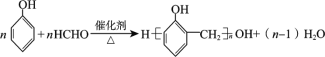
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com