
分析 (1)盐酸中C(H+)=10-a mol/L,氢氧化钡溶液中C(OH-)=10 b-14 mol/L,根据混合溶液中氢离子浓度和氢氧根离子浓度的相对大小确定溶液的pH,溶液呈中性,说明酸中氢离子物质的量等于碱溶液中氢氧根离子物质的量,根据溶液的体积关系推断酸和碱的浓度关系,从而得出结论;
(2)根据酸或碱溶液的pH结合水的离子积常数计算氢氧根离子浓度或氢离子浓度,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度;
(3)醋酸是一元弱酸,所以醋酸的浓度远远大于氢离子浓度,根据酸和碱浓度大小确定溶液体积大小,根据电荷守恒确定钠离子和醋酸根离子浓度关系.
解答 解:(1)盐酸中C(H+)=10-a mol/L,氢氧化钡溶液中C(OH-)=10 b-14 mol/L,且a+b=14,所以C(H+)=10-a mol/L=C(OH-)=10 b-14 mol/L,所以两种溶液等体积混合时,酸碱恰好中和,溶液呈中性,即pH=7;
盐酸中C(H+)=10-a mol/L,氢氧化钡溶液中C(OH-)=10 b-14 mol/L,酸碱按体积比为1:10混合后溶液显中性,则C(H+)=10-a mol/L=10C(OH-)=10×10 b-14 mol/L,所以a+b=13;
故答案为:7,a+b=13;
(2)如果a=4,则醋酸溶液中C(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$mol/L,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度,所以A溶液中水电离出的氢离子浓度为10-10mol/L,b=12的氢氧化钠溶液中氢离子浓度为10-12 mol/L;
故答案为:10-10,10-12;
(3)醋酸是弱电解质,所以醋酸溶液中C(H+)=10-a mol/L<C(CH3COOH),氢氧化钠溶液中C(OH-)=10 b-14 mol/L,且a+b=14,C(H+)=10-a mol/L=C(OH-)=10 b-14 mol/L<C(CH3COOH),要使混合后的溶液呈中性,则需要氢氧化钠的体积大于醋酸体积;溶液呈电中性,得C(H+)+c(Na+)=C(OH-)+c(CH3COO-),溶液呈中性,即C(H+)=C(OH-),所以C(Na+)=C(CH3COO-);
故答案为:<.
点评 本题考查了混合溶液中pH的计算,注意根据电荷守恒、水的离子积常数来解答即可,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 12g | B. | 16g | C. | 24g | D. | 48g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓硫酸吸收二氧化硫中混有少量SO3气体 | |
| B. | 除去NaCl晶体中少量KNO3,可以将混合物制成热的饱和溶液,然后冷却结晶,过滤 | |
| C. | HClO溶液有漂白性,无法用pH试纸或pH计测得0.1mol/L的HClO溶液的pH值 | |
| D. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2~3次的实验平均值等措施,已达到良好的实验结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
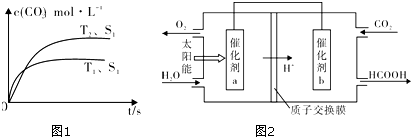
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
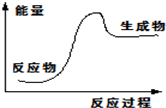
| A. | NaOH与H2SO4发生中和反应 | B. | 氧化钙和水反应 | ||
| C. | NH4Cl和Ba(OH)2•8H2O的反应 | D. | 一氧化碳气体的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S+2Fe3+→S↓+2Fe2++2H+ | B. | H2S+Fe2+→2H++FeS↓ | ||
| C. | H2S+Cu2+→CuS↓+2H+ | D. | 2H++2NO3-+3H2S→2NO↑+3S↓+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高燃料的利用效率是解决能源危机的方向 | |
| B. | 正在探索的新能源有太阳能、氢能、风能、海洋能和生物质能等 | |
| C. | 新能源的优点是可以再生、没有污染或者很少污染 | |
| D. | 燃烧热是评价燃料优劣的唯一标准 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com