
科目:高中化学 来源: 题型:
为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液、直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),通过巧妙的构思,设计了比较铜、锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),向烧杯中小心加入稀硫酸,观察到的现象是 。
甲同学的设计思路是 。
(2)乙同学接着甲的实验,向烧杯中滴加 溶液,进而观察到的现象
是 。
乙同学作出锌、铜金属活动性相对强弱的结论所依据的原理是 。
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂 溶液(作为电解液)。反应在调控下随即开始,实验中有关反应的化学方程式为 。实验中的明显现象是 。
(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌、铜金属活动性的相对强弱(简要说明操作和现象) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备的操作流程:

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
②锰酸钾
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42—)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42—会发生歧化反应。
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是______________;
实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为_______。
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。请写出实验中通入适量CO2时体系中可能发生反应离子方程式 : ;
其中氧化还原反应中氧化剂和还原剂的质量比为_________________________。
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸。从理论上分析,选用下列酸中________ ,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
 (4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式_______________________________________;
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式_______________________________________;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低。有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)。
图中A口加入的溶液最好为__________。
使用阳离子交换膜可以提高Mn元素利用率的原因为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂: 1.00 mol·L-1 HNO3、2.00 mol·L-1
HNO3,细颗粒大理石、粗颗粒大理石,35 ℃水浴。
(1)他们能完成哪些因素对速率影响的探究?
__________________________________________________________________。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol·L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
(3)整个实验中应控制的不变量是硝酸溶液体积和________。
(4)该实验小组用如图实验装置进行实验。

①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有__________。
②干燥管中应放置的试剂是______。
A.碱石灰 B.无水CaCl2
C.P2O5固体 D.浓硫酸
③若撤除干燥管装置,所测速率________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(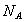 代表阿伏加德罗常数值)
代表阿伏加德罗常数值)
A. 1molNa被完全氧化为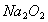 ,失去的电子数为2
,失去的电子数为2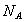
B. 常温常压下,16g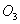 气体含有氧原子数为
气体含有氧原子数为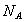
C. 常温常压下,22.4L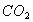 含有的分子数为
含有的分子数为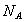
D. 18g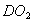 所含的电子数为10
所含的电子数为10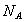
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将 (某一元酸)溶液与
(某一元酸)溶液与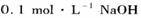 溶液等体积混合,测得混合溶液中
溶液等体积混合,测得混合溶液中 ,则此溶液中
,则此溶液中 ;
; 此溶液中由水电离出的
此溶液中由水电离出的
 溶液中由水电离出的
溶液中由水电离出的 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)将等体积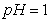 的盐酸和醋酸,加入适量水,
的盐酸和醋酸,加入适量水, 都升高了1,则加水后溶液体积V(醋酸)____V(盐酸)(填“>”、“<”或“=”)。
都升高了1,则加水后溶液体积V(醋酸)____V(盐酸)(填“>”、“<”或“=”)。
(3)常温下,某酸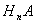 (A为酸根)与某碱
(A为酸根)与某碱 溶液恰好完全反应生成正盐,该溶液
溶液恰好完全反应生成正盐,该溶液 。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)====ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,反应物总能量<生成物总能量
B.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2
C.101 kPa时,2H2(g)+O2(g)====2H2O(g) ΔH=-483.6 kJ·mol-1, H2的燃烧热为241.8 kJ·mol-1
D.H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1,含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①CH3CH===CHCH2CH3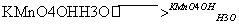 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
②R—CH===CH2 R—CH2—CH2—Br
R—CH2—CH2—Br
香豆素的主要成分是芳香内酯A,A经下列步骤转化为水杨酸。
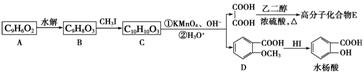
请回答下列问题:
(1)写出A的结构简式_______________________。
(2)B分子中有2个含氧官能团,分别为__________和_______(填官能团名称),B→C的反应类型为_______________________。
(3)在上述转化过程中,反应步骤B→C的目的是___________________________。
(4)下列有关A、B、C的叙述中不正确的是________(填序号)。
a.C的核磁共振氢谱中共有8组峰 b.A、B、C均可发生加聚反应
c.1 mol A最多能与5 mol氢气发生加成反应 d.B能与浓溴水发生取代反应
(5)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应,请写出其中一种的结构简式:_______________。
(6)写出合成高分子化合物E的化学反应方程式:___________________________。
(7)写出以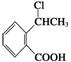 为原料制
为原料制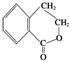 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件。合成路线流程图示例如下:
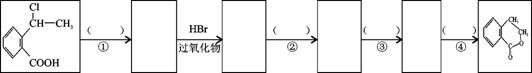
查看答案和解析>>
科目:高中化学 来源: 题型:
已知723 K时,2SO2(g)+O2(g)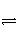
 2SO3(g) ΔH=-Q1。在相同条件下,向一密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是
2SO3(g) ΔH=-Q1。在相同条件下,向一密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是
( )
A.Q2=Q1/2 B.Q2<Q1/2 C.Q2>Q1/2 D.不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com