
【题目】![]() 时,浓度均为
时,浓度均为![]() 的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是![]()
A.BOH溶于水,其电离方程式是![]()
B.在![]()
![]() 溶液中,
溶液中,![]()
C.若一定量的上述两溶液混合后![]() ,则
,则![]()
D.若将![]()
![]() 溶液稀释至
溶液稀释至![]()
![]() ,则溶液的
,则溶液的![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。
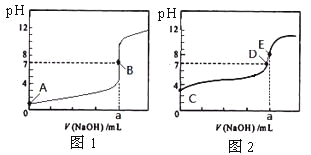
若以HA表示酸,下列说法正确的是
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=C(A-)
C. 达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D. 当0 mL<V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A—) >c(Na+)>c(H+) >c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
A.同时含有分子和离子的电解质溶液,一定是弱电解质溶液
B.pH为1的盐酸中,其![]() 是pH为3的盐酸中的100倍
是pH为3的盐酸中的100倍
C.室温时,![]() 的硫酸和
的硫酸和![]() 的NaOH溶液等体积混合,混合溶液的
的NaOH溶液等体积混合,混合溶液的![]()
D.![]() 溶液和
溶液和![]() 盐酸中,其水电离出的
盐酸中,其水电离出的![]() 相等
相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义,该反应为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
回答下列问题:
(1)0~5min时间内用H2表示的化学反应速率为___mol/(L·min)。
(2)达平衡时CH4的物质的量分数为___,CO2的转化率是___。
(3)反应前后混合气体的压强之比为___。
(4)为了加快反应速率,可采取什么措施___(写两条)。
(5)下表中的数据是破坏1mol物质中的化学键所消耗的能量:
物质 | CH4 | CO2 | CO | H2 |
能量/kJ | 1660 | 1490 | 1072 | 436 |
该催化重整反应中反应物的总能量___生成物的总能量(填“大于”或“小于”)。
(6)下列能表示该反应已经达到化学平衡状态的是___。
A.v逆(CH4)=2v正(CO)
B.CO2的浓度保持恒定
C.混合气体平均相对分子质量不变
D.混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
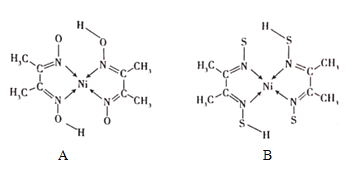
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
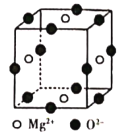
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2 L Cl2溶于水,溶液中Cl-,ClO-和HClO的微粒数之和为NA
B.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.1 mol PC13与1 mol 36C12反应达到平衡时,产物中含P—36C1键数目为2NA
D.反应![]() +
+ ![]() →
→ ![]() +
+ ![]() 中,每生成294g
中,每生成294g ![]() 释放的中子数为3NA
释放的中子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期主族元素,a、d分别是A、D元素对应的单质,m、n、p、q是由这些元素中的部分元素组成的化合物,气体p常作果实催熟剂,m、n为两种常见的液体。上述物质发生的转化关系如下图所示(反应条件已略去)。下列说法错误的是
![]()
A.原子半径由大到小的顺序为:D>B>C>A
B.简单氢化物的沸点:B<C
C.d与m反应的现象为浮在液面上四处游动
D.C与D形成的化合物中一定含有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com