
| A. | 强碱性的溶液中,Na+、S2-、[Al(OH)4]-、SO32- | |
| B. | 酸性溶液中,Fe2+、Na+、NO3-、SO42- | |
| C. | 能与铝放出H2的溶液中、K+、Cu2+、NO3-、SO42- | |
| D. | 无色溶液中Ca2+、Cu2+、ClO-、NO3- |
分析 A.碱性条件下离子之间不发生任何反应;
B.酸性条件下离子发生氧化还原反应;
C.能与铝放出H2的溶液可能为强碱性或非氧化性酸溶液;
D.有颜色的离子不能存在.
解答 解:A.碱性条件下离子之间不发生任何反应,可大量共存,故A正确;
B.酸性条件下Fe2+、NO3-离子发生氧化还原反应,不能大量共存,故B错误;
C.能与铝放出H2的溶液可能为强碱性或非氧化性酸溶液,碱性条件下Cu2+不能大量存在,酸性条件下不能存在NO3-离子,否则不能生成氢气,故C错误;
D.Cu2+有颜色,不能存在,故D错误.
故选A.
点评 本题考查离子共存问题,为高频考点,侧重于学生的分析能力的考查,难度不大,本题注意把握题中各项要求,为解答该题的关键,学习中注意把握相关离子的性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12 g | B. | 2.24 g | C. | 3.36 g | D. | 6.40 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 请回答:
请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
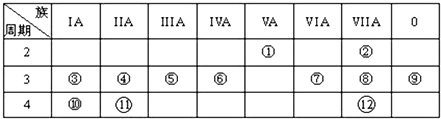
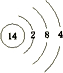 ,写出①的气态氢化物分子的电子式
,写出①的气态氢化物分子的电子式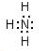 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氢氧化钠 | 二氧化碳 |
| C | 小苏打 | 盐酸 | 铁 | 氨气 |
| D | 硫酸 | 食盐水 | 氯化铜 | 纯碱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在密闭定容体系中降温,混合气颜色变浅,体系压强增大 | |
| B. | 只降温,混合气体颜色变浅,说明正反应是放热的 | |
| C. | 加压时,混合气颜色开始变浅,后来又逐渐加深 | |
| D. | 加压时,混合气颜色开始变深,后来又逐渐变浅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com