
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
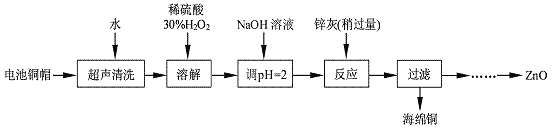
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式: ;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 ;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3[ | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为 ,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会 (填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)= mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
② ;③过滤;
④ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。
【答案】(1)Cu+H2O2+2H+=Cu2++2H2O;
(2)①淀粉溶液 蓝色褪去
②80.99﹪或 0.8099;偏高;
(3)2×10-10
(4)②滴加1.0 mol·L-1NaOH,调溶液pH 约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
④向滤液中滴加1.0 mol·L-1NaOH,调节溶液pH 约为10(或8.9≤pH≤11),使Zn2+沉淀完全
【解析】
试题分析:(1)因为双氧水在酸性溶液中先把铜氧化成氧化铜,当然这是一个微弱的反应,形成一个平衡,但是形成的氧化铜马上就会被稀硫酸溶解,平衡被打破,反应朝正方向进行,故而逐渐溶解,反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O;故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(2)①淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点,故答案为:淀粉溶液;蓝色褪去;
②根据题中数据可知,第一次数据偏差较大,为偶然误差,应去掉,所以Na2S2O3标准溶液的体积为![]() mL=25.31mL,则消耗的Na2S2O3的物质的量为0.1000mol/L×0.02531L=0.002531mol,根据反应2Cu2++4I-═2CuI(白色)↓+I2、2S2O32-+I2═2I-+S4O62-得关系式2Cu2+~I2~2S2O32-,根据关系可求得铜元素的质量为0.002531mol×
mL=25.31mL,则消耗的Na2S2O3的物质的量为0.1000mol/L×0.02531L=0.002531mol,根据反应2Cu2++4I-═2CuI(白色)↓+I2、2S2O32-+I2═2I-+S4O62-得关系式2Cu2+~I2~2S2O32-,根据关系可求得铜元素的质量为0.002531mol×![]() ×64g/mol=0.8099g,所以铜的质量分数为
×64g/mol=0.8099g,所以铜的质量分数为![]() ×100%=80.99%,若滴定前溶液中的H2O2没有除尽,则加入碘离子后双氧水氧化碘离子产生的碘单质,会导致Na2S2O3标准溶液消耗偏大,则所测定c (Cu2+)将会偏大,故答案为:80.99%;偏高;
×100%=80.99%,若滴定前溶液中的H2O2没有除尽,则加入碘离子后双氧水氧化碘离子产生的碘单质,会导致Na2S2O3标准溶液消耗偏大,则所测定c (Cu2+)将会偏大,故答案为:80.99%;偏高;
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成氢氧化铜沉淀,溶液中剩余的氢氧化钠的物质的量浓度为![]() =0.00001mol/L,所以c(Cu2+)=
=0.00001mol/L,所以c(Cu2+)=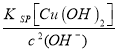 =
=![]() mol/L=2×10-10mol/L,故答案为:2×10-10;
mol/L=2×10-10mol/L,故答案为:2×10-10;
(4)由除去铜的滤液制备ZnO 的实验步骤依次为:①①向滤液中加入30%H2O2,使其充分反应,目的使Fe2+转化完全为Fe3+;②滴加NaOH溶液,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全,③过滤,④向滤液中滴加1.0molL-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全,⑤过滤、洗涤、干燥;⑥900℃煅烧,制得氧化锌,故答案为:②滴加1.0molL-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;④向滤液中滴加1.0molL-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全。


科目:高中化学 来源: 题型:
【题目】下列对能量转化的认知中,不正确的是( )
A.电解水生成H2和O2时,电能主要转化为化学能
B.风力发电时,风能主要转化为电能
C.煤燃烧时,化学能主要转化为热能
D.白炽灯工作时,电能全部转化为光能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同.
完成下列填空:
(1)HClO的电子式为_________;
(2)第一次氧化时,溶液的pH应调节为_________(选填“酸性”、“碱性”或“中性”);原因是_________;
(4)写出第二次氧化时发生反应的离子方程式_________;
(3)处理100m3含NaCN 10.3mg/L的废水,实际至少需NaClO________ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5mg/L,达到排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液能与镁反应放出氢气,此溶液中可能大量共存的离子组是( )
A.H+、Ba2+、Mg2+、Cl-
B.K+、Cl-、SO42-、AlO2-
C.K+、OH-、SO32-、MnO4-
D.Ca2+、H+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是( )
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.分子晶体的熔点一定比金属晶体的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 元素周期表有7个周期、18个族
B. 天然气是一种清洁的化石燃料
C. 工业上常用电解NaCl水溶液的方法制取金属钠
D. 淀粉和纤维素互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亮菌甲素为利胆解痉药适用于急性胆囊炎治疗等,其结构简式如图。下列有关叙述正确的是
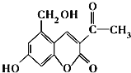
A.亮菌甲素中含有四种官能团
B.每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子
C.1mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗3molNaOH
D.亮菌甲素能与Na、NaOH溶液、Na2CO3溶液、NaHCO3溶液都能发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com