
| A. | 0.9%氯化钠溶液 | B. | 0.9%氯化铵溶液 | ||
| C. | 1.25%碳酸氢钠溶液 | D. | 5%葡萄糖溶液 |
科目:高中化学 来源: 题型:选择题
| A. | CO2的分子模型示意图: | |
| B. | 氯化铵的电子式: | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | NH3、H2O、CO2、HCl四分子中孤电子对最多的是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①中X2+是氧化产物 | B. | 还原性强弱的顺序为:Z->A2+ | ||
| C. | 氧化性强弱的顺序为:XO4->B2 | D. | 溶液中可发生:Z2+2A2+=2A3++2Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
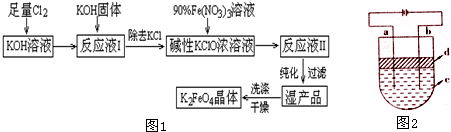
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com