
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 冰镇的啤酒打开后泛起泡沫
B. 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
C. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
D. 黄绿色的氯水光照后颜色变浅
【答案】B
【解析】试题分析:A、因溶液中存在二氧化碳的溶解平衡,开启啤酒瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故A不选;B.由H2(g)、I2(g)、HI(g)气体组成的平衡体系,增大压强平衡不移动,但浓度增大,则颜色加深,不能用勒沙特列原理解释,故B选;C、工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来,使平衡向正反应方向移动,能用勒夏特列原理解释,故C不选;D.氯水中的次氯酸受光照射会分解,次氯酸浓度减小,使得化学平衡Cl2+H2O
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来,使平衡向正反应方向移动,能用勒夏特列原理解释,故C不选;D.氯水中的次氯酸受光照射会分解,次氯酸浓度减小,使得化学平衡Cl2+H2O![]() HCl+HClO正向移动,氯气浓度减小,颜色变浅,能用勒夏特列原理解释,故D不选;故选B。
HCl+HClO正向移动,氯气浓度减小,颜色变浅,能用勒夏特列原理解释,故D不选;故选B。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】维生素是参与生物生长发育和新陈代谢所必须的物质,中学生每天需要补充一定量的维生素C。下列食品中维生素C含量最丰富的是
A.植物油 B.馒头 C.牛肉 D.橙子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于一定空间运动状态的电子在原子核外出现的概率密度分布可用________形象化描述。在基态14C原子中,核外存在________对自旋相反的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,在向滤液中加入适量的盐酸,这种试剂是
A. NH3·H2O B. NaOH C. Na2CO3 D. MgCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
(1)下列微粒可以大量共存的是________(填字母)。
a.CO![]() 、HSO
、HSO![]() b.HCO
b.HCO![]() 、HSO
、HSO![]()
c.SO![]() 、HCO
、HCO![]() d.H2SO3、HCO
d.H2SO3、HCO![]()
(2)已知NaHSO3溶液显酸性,解释原因:_____________________________;
NaHSO3的稀溶液中各离子浓度从大到小的排列顺序是_____________________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度从大到小的顺序为____________________________。
浓度从大到小的顺序为____________________________。
(4)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________________。
Ⅱ.Na2S2O5(焦亚硫酸钠)是常见的食品抗氧化剂之一。
(5)将0.5 mol Na2S2O5溶于水配成1 L溶液,该溶液pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化情况如图所示。写出Na2S2O5溶于水的化学方程式:____________________________;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是________________________。pH=3时,溶液中主要含硫粒子浓度的大小关系为________。
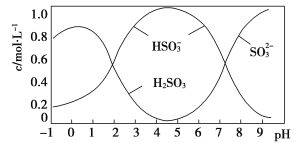
(6)已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO3)=5.0×10-7。将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO![]() 沉淀完全[c(SO
沉淀完全[c(SO![]() )≤1.0×10-5mol·L-1],此时溶液中c(SO
)≤1.0×10-5mol·L-1],此时溶液中c(SO![]() )≤________mol·L-1。
)≤________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,2 mol X2(气)和6 mol Y2(气)化合生成4 mol的气体化合物,则该气体化合物的化学式为
A.XY3 B.XY C.X3Y D.X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
 (1)写出该反应的平衡常数表达式:K= 。
(1)写出该反应的平衡常数表达式:K= 。
已知:![]() >
>![]() ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2浓度的变化的曲线是 。

用O2表示从0—2s内该反应的平均速率υ(O2)= 。
(3)能说明该反应已达到平衡状态的是 。
a.C(NO2)=2C(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4) 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质X的结构简式如图所示,它常被用于制香料或作为饮料酸化剂,在医学上也有广泛用途。下列关于物质X的说法正确的是( )
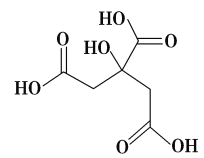
A.X的分子式为C6H7O7
B.X分子内所有原子均在同一平面内
C.1 mol物质X最多可以和3 mol氢气发生加成反应
D.足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com