
| A. | HA电离出的c(H+)与水电离出的c(H+)之比为108 | |
| B. | 升高温度,溶液的pH减小 | |
| C. | 溶液的pH=4 | |
| D. | HA的电离平衡常数约为l×10-7 |
分析 A.HA电离出的c(H+)为0.1mol/L×0.1%,利用Kw来计算水电离产生的氢离子浓度;
B.温度升高促进电离,氢离子浓度越大,pH越小;
C.利用氢离子的浓度计算pH;
D.根据电离度及离子的浓度计算电离平衡常数.
解答 解:A.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离产生的氢离子浓度为10-10mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故A错误;
B.温度升高促进弱酸的电离,氢离子浓度变大,则pH变小,故B正确;
C.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,故C正确;
D.由HA?H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7,故D正确;
故选A.
点评 本题考查弱电解质的电离平衡及其影响,题目难度中等,明确离子的浓度、温度对电离平衡的影响及离子积的计算即可解答,试题培养了学生的分析能力及灵活应用能力.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应①是置换反应 | B. | ①②均属于氧化还原反应 | ||
| C. | 每消耗1mol TiO2会生成56g CO | D. | 反应②中镁元素化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
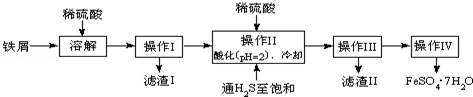
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制240mL 0.1mol/LCuSO4溶液需称取胆矾6.3g | |
| B. | 金属氧化物一定是碱性氧化物 | |
| C. | 1L水中溶解58.5g NaCl,该溶液中NaCl的物质的量浓度为1 mol•L-1 | |
| D. | 胶体区别于其他分散系的本质特征是能够产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 实验目的 |
| A | 过氧化钠与水反应 | 制备少量干燥的氧气 |
| B | 取铁在氧气中充分燃烧后的固体产物溶于稀硫酸,加KSCN溶液 | 检验铁的燃烧产物中含+3价铁 |
| C | 分别取大小相近的钠粒、钾粒投入水中,观察反应的剧烈程度 | 比较钠、钾的还原性强弱 |
| D | 将CO2气体通入Na2SiO3溶液中 | 比较C、Si元素非金属性的强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 总反应速率由反应②决定 | |
| B. | 在(NH4)2S2O8消耗完后,溶液一定显蓝色 | |
| C. | 若能观察都蓝色出现,刚起始时,n(Na2S2O3)=n[(NH4)2S2O8] | |
| D. | 升高温度,①、②的反应速率均加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com